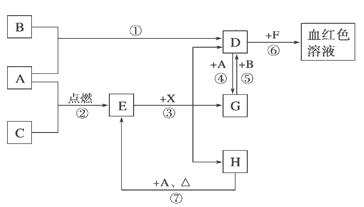
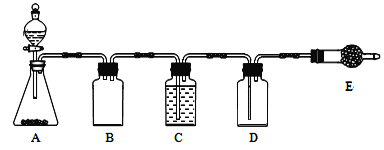
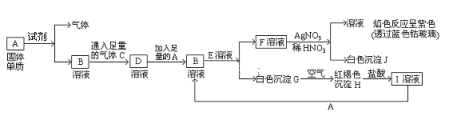
题目内容
【题目】(1)在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,则该混合气体的平均摩尔质量为_________,其中CH4和CO2的物质的量之比为_____。
(2)将17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液中OH-的物质的量浓度是__________mol/L。
(3)在标准状况下,VL某气体(摩尔质量为M g/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的物质的量浓度c=__________mol/L(用以上字母表示,且必须化简)。
(4)实验室用MnO2与浓盐酸制取Cl2,发生反应的化学方程式:_____。ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应:NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式________________。生成0.2molClO2转移的电子数目为_____________。
(5)取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为__________________________。如果向FeBr2溶液中通入等物质的量的Cl2,该反应的离子方程式为________________________________。
【答案】30g/mol 1:1 0.2 ![]() MnO2+4HCl(浓)
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O 0.2NA 6:3:2 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
MnCl2+Cl2↑+2H2O 5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O 0.2NA 6:3:2 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
【解析】
(1)根据n=V/Vm、m=nM以及十字交叉法计算;
(2)根据c=n/V、m=nM以及稀释过程中溶质的物质的量不变解答;
(3)根据c=n/V、n=V/Vm结合溶液的密度解答;
(4)浓盐酸和二氧化锰在加热的条件下反应生成氯化锰、氯气和水,据此书写;根据元素的化合价变化情况结合电子得失守恒配平和计算;
(5)根据得失电子守恒以及还原剂的还原性强弱顺序分析解答。
(1)在标准状况下,4.48LCH4和CO2的混合气体的物质的量是4.48L÷22.4L/mol=0.2mol,其质量为6.0g,则该混合气体的平均摩尔质量为6.0g÷0.2mol=30g/mol;根据十字交叉法可知CH4和CO2的物质的量之比为![]() 。
。
(2)17.1gBa(OH)2溶解在水中,配成100mL溶液,溶质的物质的量是17.1g÷171g/mol=0.1mol,则氢氧化钡的浓度是0.1mol÷0.1L=1.0mol/L,因此氢氧根的浓度是2.0mol/L。配好后从中取出10mL溶液,加水稀释至100mL,稀释了10倍,根据稀释过程中溶质的物质的量不变可知稀释后所得溶液中OH-的物质的量浓度是2.0mol/L÷10=0.2mol/L。
(3)在标准状况下,VL某气体(摩尔质量为M g/mol)溶解在1L水(水的密度近似为1g/cm3)中,气体的物质的量是![]() ,质量是
,质量是![]() 。假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的体积是
。假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3,则所得溶液的体积是![]() ,因此物质的量浓度c=
,因此物质的量浓度c=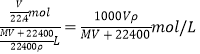 ;
;
(4)浓盐酸和二氧化锰在加热的条件下反应生成氯化锰、氯气和水,发生反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。反应中NaClO2→ClO2,+3价的氯元素化合价升高到+4价,NaClO2→NaCl,+3价的氯元素的化合价降低到-1价,由得失电子守恒可知,方程式为5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O;生成4molClO2,转移电子4mol,生成0.2molClO2转移电子的物质的量为0.2mol,数目为0.2NA;
MnCl2+Cl2↑+2H2O。反应中NaClO2→ClO2,+3价的氯元素化合价升高到+4价,NaClO2→NaCl,+3价的氯元素的化合价降低到-1价,由得失电子守恒可知,方程式为5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O;生成4molClO2,转移电子4mol,生成0.2molClO2转移电子的物质的量为0.2mol,数目为0.2NA;
(5)向KI、Na2SO3、FeBr2溶液中分别通入足量氯气均发生氧化还原反应,且反应恰好完全时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2失去电子数相等,设KI、Na2SO3、FeBr2的物质的量分别为x、y、z,由失去的电子数相等可知,x×(1-0)=y×(6-4)=z×(3-2)+z×2×(1-0),解得x:y:z=6:3:2,由于溶液体积相等,则浓度之比为6:3:2;向FeBr2溶液中通入等物质的量的Cl2,先与亚铁离子反应,再与溴离子反应,其反应方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-。

 名校课堂系列答案
名校课堂系列答案【题目】下列各组物质之间不能通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| SiO2 | Na2SiO3 | Si | H2SiO3 |
B | Na2O | Na2O2 | Na | NaOH | |
C | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
D | FeCl2 | FeCl3 | Fe | CuCl2 |
A. A B. B C. C D. D