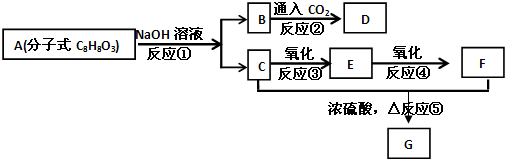
题目内容
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
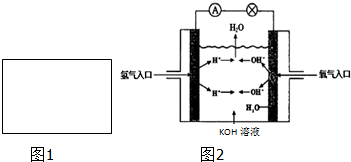
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图(图1),标出正、负极及材料、电解质溶液并写出电极反应式.正极反应 ;负极反应 .
(3)氢氧燃料电池是符合绿色化学理念的新型发电装置.图2为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
①负极反应式为 ,正极反应式为 ,溶液PH (填“增大”、“不变”或“减小”)
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
2LiH
Ⅱ.LiH+H2O═LiOH+H2↑
反应Ⅰ中的还原剂是 ,7g Li可吸收标况下H2 L,此时转移电子 mol.

(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式:
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图(图1),标出正、负极及材料、电解质溶液并写出电极反应式.正极反应
(3)氢氧燃料电池是符合绿色化学理念的新型发电装置.图2为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
①负极反应式为
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
| ||
Ⅱ.LiH+H2O═LiOH+H2↑
反应Ⅰ中的还原剂是
考点:原电池和电解池的工作原理,氧化还原反应
专题:氧化还原反应专题,电化学专题
分析:(1)氯化铁具有氧化性,能和Cu发生氧化会反应生成氯化亚铁和氯化铜;
(2)该反应中,铜发生氧化反应作负极、不如铜活泼的金属或导电的非金属作负极,氯化铁溶液作电解质溶液;
(3)①碱性溶液中负极反应为2H2-4e-+4OH-=4H2O,正极反应为O2+4e-+2H2O=4OH-,电池总反应都为2H2+O2=2H2O;
②氧化还原反应中,还原剂被氧化,所含元素化合价升高,结合反应的化学方程式计算.
(2)该反应中,铜发生氧化反应作负极、不如铜活泼的金属或导电的非金属作负极,氯化铁溶液作电解质溶液;
(3)①碱性溶液中负极反应为2H2-4e-+4OH-=4H2O,正极反应为O2+4e-+2H2O=4OH-,电池总反应都为2H2+O2=2H2O;
②氧化还原反应中,还原剂被氧化,所含元素化合价升高,结合反应的化学方程式计算.
解答:
解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,
,
故答案为: ;2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+;
;2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+;
(3)①碱性溶液中负极反应为2H2-4e-+4OH-=4H2O,正极反应为O2+4e-+2H2O=4OH-,电池总反应都为2H2+O2=2H2O,溶液体积增大,OH-浓度减小,则pH减小,
故答案为:2H2-4e-+4OH-=4H2O;O2+4e-+2H2O=4OH-;减小;
②反应Ⅰ中Li元素化合价升高,被氧化,Li为还原剂,n(Li)=
=1mol,由方程式可知7g Li可吸收标况下H20.5mol,标准状况下的体积为11.2L,转移电子1mol,
故答案为:Li;11.2;1.
(2)设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为
 ,
,故答案为:
 ;2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+;
;2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+;(3)①碱性溶液中负极反应为2H2-4e-+4OH-=4H2O,正极反应为O2+4e-+2H2O=4OH-,电池总反应都为2H2+O2=2H2O,溶液体积增大,OH-浓度减小,则pH减小,
故答案为:2H2-4e-+4OH-=4H2O;O2+4e-+2H2O=4OH-;减小;
②反应Ⅰ中Li元素化合价升高,被氧化,Li为还原剂,n(Li)=
| 7g |
| 7g/mol |
故答案为:Li;11.2;1.
点评:本题考查了原电池原理,为高频考点,涉及电极反应式的书写、原电池的设计以及计算等问题,根据得失电子确定正负极,再结合正负极上发生的反应来分析解答,注意相关基础知识的积累,难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
2012年4月,中央电视台曝光了不法商贩将重金属铬(Cr)超标的工业明胶加工成药用胶囊的“毒胶囊”事件.已知铬的原子序数为24,一种同位素的质量数为53,下列叙述正确的是( )
| A、铬位于元素周期表的第Ⅷ族 | ||
| B、铬所在的周期有18种元素 | ||
| C、其原子质量是12C原子质量的53倍 | ||
D、中子数为29,铬原子符号表示为
|
对于化合物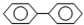 ,下列叙述中正确的是( )
,下列叙述中正确的是( )
 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A、其化学式为C12H12 |
| B、分子中所有原子有可能处于同一平面 |
| C、该化合物分子中所有原子不可能处于同一平面 |
| D、分子中所有原子一定处于同一平面 |
盛装下列溶液的试剂瓶采用的是玻璃塞的是( )
| A、Na2SiO3 |
| B、Na2CO3 |
| C、NH4Cl |
| D、HF |
近年来科学家们发现由100个碳原子构成具有完美对称性的C100分子,最内部是由20个碳原子构成的正12面体,外层的60个碳原子形成12个独立的正五边形,处于中间层次的20个碳原子将内外层碳原子连接在一起,当C100与足量氢气完全反应时,每个碳原子形成四个共价单键,其产物的分子式应为( )
| A、C100H100 |
| B、C100H80 |
| C、C100H60 |
| D、C100H40 |