题目内容
为检验在空气中暴置过的过氧化钠的变质程度,某学习小组的甲、乙、丙三位同学经研究讨论,为减小实验的误差,分工协作如下:分别用等量的过氧化钠样品进行实验。
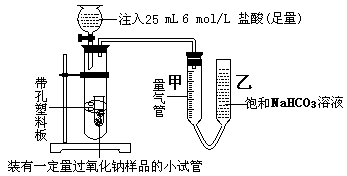
⑴甲同学采用如图实验装置,

甲同学测量气体时,实验过程中,量气管甲的前后示数差为473 mL(已折成标准状况下的体积), 实验后量气管甲中气体的主要成分有 。
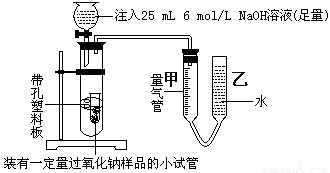
⑵乙同学采用如图实验装置,
乙同学测量气体时,实验过程中,量气管甲的前后示数差为249 mL(已折成标准状况下的体积),乙同学的实验中,所用NaOH溶液的作用是:
① ;
② 。
⑶丙同学用浓度为1.00 mol/L的标准盐酸滴定过氧化钠样品,应选用的玻璃仪器有:
。
从实验目的分析丙同学所采用的指示剂为 。丙同学实验完毕,从滴定管前后的示数得知消耗标准盐酸100.00 mL。
⑷利用上述实验数据,计算该过氧化钠样品变质的百分率为 。指导教师在批阅该实验小组的实验报告时,指出两点不足,可能引起实验误差:
① ;
② 。
⑴CO2、O2、N2(2分,少一种气体扣1分,不倒扣分))
⑵利用NaOH溶液中的水与过氧化钠反应(1分);使生成气体只有氧气,避免了碳酸钠在酸性条件下生成二氧化碳(1分)
⑶烧环、锥形瓶、酸式滴定管(2分),甲基橙(2分)
⑷60%(3分);甲同学实验中由于盐酸的挥发,在量气管甲中又生成了二氧化碳,所以气体读数偏大(2分)、丙同学在中和滴定实验时,不能只标定一次,应标定2~3次,用平均值计算(2分)。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案