题目内容
下列说法中正确的是
| A.二氯甲烷(CH2Cl2)分子的中心原子是SP3杂化,键角均为109°28′ |
| B.CH2O和ClO4– 的中心原子上都含有孤对电子 |
| C.BCl3、PCl5、H2O分子中均有一个原子的最外层电子不满足了8e-稳定结构 |
| D.由原子间通过共价键形成的晶体一定比其他类别晶体熔、沸点高 |
C
试题分析:A项:二氯甲烷(CH2Cl2)分子的结构不是正四面体结构,故错;B项:CH2O中心原子C和2个H一个O形成了四个键,没有孤立电子,故错;D项:由原子间通过共价键形成的分子晶体就没有离子晶体熔、沸点高,故错。故选C。
点评:本题考查的是原子结构好物质的性质的相关知识,题目难度不大,注意分子结构特点和杂化轨道的学习。

练习册系列答案
相关题目
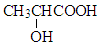 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子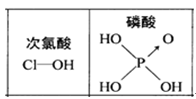
 )
)