题目内容
17.锂硫电池放电时反应为2Li+S=Li2S,其装置如图所示.下列关于该电池的说法正确的是( )
| A. | Li作正极 | B. | 电池工作时Li被还原 | ||
| C. | 电子由S经导线流向Li | D. | 实现了化学能向电能的转化 |
分析 锂硫电池放电时反应为2Li+S=Li2S,Li失电子作负极,S得电子为正极,电子从负极流向正极,据此分析.
解答 解:A.由原电池反应可知,Li失电子作负极,故A错误;
B.原电池中负极发生氧化反应,即Li发生氧化反应,故B错误;
C.电子从负极流向正极,则电子由Li经导线流向S,故C错误;
D.该装置为原电池,向外提供电能,即实现了化学能向电能的转化,故D正确;
故选D.
点评 本题考查原电池,为高频考点,侧重于对原电池原理的考查,题目难度不大,注意根据电池总反应判断正负极材料及电极反应.

练习册系列答案
相关题目
8.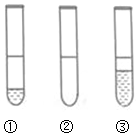 在3支试管中分别装有:①lmL苯和3mL水:②lmLCCl4和3mL水;③lmL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别装有:①lmL苯和3mL水:②lmLCCl4和3mL水;③lmL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )
 在3支试管中分别装有:①lmL苯和3mL水:②lmLCCl4和3mL水;③lmL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别装有:①lmL苯和3mL水:②lmLCCl4和3mL水;③lmL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )| A. | ①②③ | B. | ①③② | C. | ③②① | D. | ②③① |
5.反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45mol•L-1•min-1②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1④v(D)=0.45mol•L-1•s-1
则该反应进行的快慢顺序为( )
①v(A)=0.45mol•L-1•min-1②v(B)=0.6mol•L-1•s-1
③v(C)=0.4mol•L-1•s-1④v(D)=0.45mol•L-1•s-1
则该反应进行的快慢顺序为( )
| A. | ④>③=②>① | B. | ④<③=②<① | C. | ②>④>③>① | D. | ④>③>②>① |
12.环扁桃酸酯的结构简式如图所示,下列说法不正确的是( )


| A. | 环扁桃酸酯的分子式为 C17H24O3 | |
| B. | 环扁桃酸酯在水中几乎不溶,在乙醇或丙酮中易溶解 | |
| C. | 环扁桃酸酯可以发生加成、取代、消去反应 | |
| D. | 环扁桃酸酯分子中含3个手性碳原子 |
2.下列各组物质中,互称为同分异构体的是( )
| A. | 水与冰 | B. | O2与O3 | C. | 乙烷和正丁烷 | D. |  与 与 |
9.下列说法正确的是( )
| A. | 标准状况下,22.4L H2和O2的混合物所含分子数为NA | |
| B. | 标准状况下,18g H2O的体积是22.4L | |
| C. | 在常温常压下,11.2L N2含有的分子数为0.5NA | |
| D. | 1mol SO2的体积是22.4L |
6.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.76 kJ•mol-1 | |
| B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1 451.52 kJ•mol-1 | |
| C. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-725.76 kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 451.52 kJ•mol-1 |
7.下列化合物分子中的所有碳原子不可能处于同一平面的是( )
| A. | 硝基苯 | B. | 异丁烷 | C. | 苯 | D. | CH3-CH=CH-CH3 |