题目内容
已知在常用催化剂(如铂、钯)的催化下,氢气和炔烃加成生成烷烃,难于得到烯烃,但使用活性较低的林德拉催化剂[Pd/(PbO、CaCO3),其中钯附着于碳酸钙及少量氧化铅上],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示仪器组装而成的实验装置(铁架台未画出),拟由乙炔制得乙烯,并测定乙炔氢化的转化率。若用含0.020molCaC2的电石和1.60g含杂质18.7%的锌粒(杂质不与酸反应)分别与足量的X和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水VmL。试回答有关问题: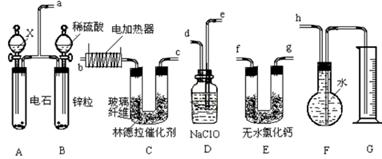
(1)装置的连接顺序是a、 、 、 、 、 、 、h(填各接口的字母)。
(2)写出A中所发生反应的化学方程式(有机物写结构简式): 。
(3)D的作用是___________________。
(4)为减慢A中的反应速率,X应选用____________________________。
(5)F中留下的气体除含C2H4、少许空气外,还有 。G所选用的量筒的容积较合理的是_____。(标准状况下)
A.500mL B.1000mL C.2000mL
(6)乙炔氢化的转化率为(用V来表示)_______________。
(12分)(1)a、e、d、f、g、b、c、h(f、g可调换);
(2)CaC2 + 2H2O HC≡CH↑+ Ca(OH)2;
HC≡CH↑+ Ca(OH)2;
(3)除去杂质气体; (4)饱和食盐水;
(5)H2、C2H2; B; (6)(896-V)/448。
解析试题分析:(1)由于生成的乙炔中含有还原性的杂质气体,所以需要用氧化剂次氯酸钠除去,另外在反应之前还需要干燥混合气。最后通过排水法收集剩余的气体,所以正确的操作顺序是a、e、d、f、g、b、c、h(f、g可调换)。
(2)A装置是制备乙炔的,则A中所发生反应的化学方程式是CaC2 + 2H2O HC≡CH↑+ Ca(OH)2。
HC≡CH↑+ Ca(OH)2。
(3)次氯酸钠具有强氧化性,除去H2S气体中的杂质气体。
(4)为减慢A中的反应速率,X应选用饱和食盐水。
(5)F中留下的气体除含C2H4、少许空气外,还有氢气和乙炔。由于乙炔本身的产量根据0.02mol计算为约448ml。锌的物质的量是(1.60g×81.3%)÷65g/mol=0.02,所以生成的氢气体积大约是448ml。当乙炔和氢气完全不反应的时候(比如催化剂失效了),两个体积是相加的关系:4480ml+4480ml=896ml。只有当完全反应时最终产物体积才为448ml。由于大部分有机反应均为不完全反应,所以很有可能最终体积在448ml与896ml之间。所以用1000ml最合适,答案选B。
(6)反应中体积差是896ml-Vml,则根据反应的方程式可知参加反应的乙炔就是896ml-Vml,所以乙炔的转化率是(896-V)/448。
考点:考查乙炔的制备、物质的除杂、化学实验操作以及物质转化率的计算
点评:该题是高考中的常见题型,难度大,综合性强,对学生的要求高。试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

 (1)所用装置的连接顺序是a、 、 、 、 、 、 、h(填各接口的字母)。
(1)所用装置的连接顺序是a、 、 、 、 、 、 、h(填各接口的字母)。

 (1)所用装置的连接顺序是a、 、 、
、
、
、
、h(填各接口的字母)。
(1)所用装置的连接顺序是a、 、 、
、
、
、
、h(填各接口的字母)。