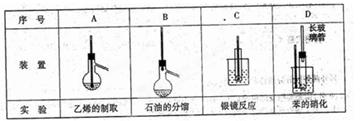
题目内容
下列物质的保存方法不正确的是
| A.钠保存在石蜡或煤油中 |
| B.保存Fe2(SO4)3溶液需加入少量铁粉 |
| C.氯水保存在棕色试剂瓶中 |
| D.盛装Na2SiO3溶液的试剂瓶不能用玻璃塞 |
B
试题分析:钠是活泼的金属,极易被氧化,能和水反应,A正确;硫酸铁能和铁反应生成硫酸亚铁,B不正确,应该加入适量的稀硫酸。C中氯水见光以分解,需要保存在棕色试剂瓶中,C正确;硅酸钠溶液具有很强的碱性,不能用玻璃塞,D正确,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见考点。该题的关键是明确常见化学试剂的性质,包括物理性质和化学性质,然后有针对性的选择即可。

练习册系列答案
相关题目
 N2O4(无色),减压时,气体颜色变浅,平衡向正反应方向移动
N2O4(无色),减压时,气体颜色变浅,平衡向正反应方向移动 加入96mL水中
加入96mL水中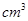 )
)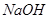 溶液
溶液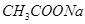 溶液中滴入酚酞溶液,加热
溶液中滴入酚酞溶液,加热