��Ŀ����
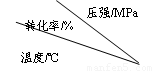
��9�֣���ҵ����������ʱ�����ô�������Ӧ��SO2 ת��ΪSO3��һ���ؼ����衣ѹǿ���¶ȶ�SO2ת���ʵ�Ӱ�����±���ԭ�������ɷֵ��������Ϊ��SO2 7%��O2 11%��N2 82%����
|
|
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
��1�����ñ��������ƶ�SO2�������� ������ȡ����ȡ�����Ӧ��
��2����400~500��ʱ��SO2�Ĵ��������� �����ѹ����ѹ������
��3��ѡ�����˵Ĵ������Ƿ�������SO2��ת���ʣ� ����ǡ������Ƿ��������÷�Ӧ���ų��������� ����ǡ�����
��4��Ϊ���SO3�����ʣ�ʵ���������� ����SO3��
��5����֪��2SO2��g����O2��g����2SO3��g������H����196.6kJ��mol��1������ÿ����1���98%��������Ҫ��SO3��������SO2������ЩSO3���ų���������
���𰸡�
��1������ ��1�֣���2����ѹ ��1�֣���3����1�֣����� ��1�֣�
��4��98.3%��ŨH2SO4 ��1�֣�
��5��8��103t 9.83��109kJ ����2�֣�
��������

��ϰ��ϵ�д�
�����Ŀ