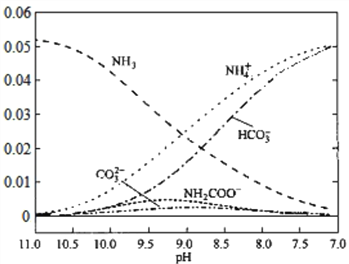
题目内容
【题目】烃D是一种重要的化工原料且在标准状况下的密度为1.25 gL1,E能发生银镜反应,C与乙酸、乙醇均发生酯化反应且分子中含有甲基。有关物质的转化关系如下图所示。
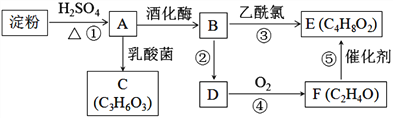
(1)A中所含官能团的名称为________________。
(2)C的结构简式为________________。
(3)已知乙酰氯的结构简式为![]() ,反应③的化学方程式为_________________。
,反应③的化学方程式为_________________。
(4)下列说法正确的是________。
A.判断反应①是否完全,可用碘水检验
B.两分子C发生酯化反应生成环状的酯
C.一定条件下,A、B、C、E都能与NaOH反应
D.反应⑤为加成反应,也属于酯化反应
【答案】 羟基、醛基 ![]()
![]() AB
AB
【解析】烃D是一种重要的化工原料且在标准状况下的密度为1.25 gL1,D的分子量为1.25×22.4=28,D为乙烯,淀粉水解生成葡萄糖(A),葡萄糖分解生成二氧化碳和乙醇(B),乙醇发生消去反应生成乙烯(D);乙烯氧化为乙醛(F),乙醛含有醛基,能够发生银镜反应,C与乙酸、乙醇均发生酯化反应且分子中含有甲基,所以C的结构简式为CH3CHOHCOOH。
(1)综上所述,A为葡萄糖,所含官能团的名称为羟基、醛基;正确答案:羟基、醛基。
(2)综上所述,C的结构简式为![]() ;正确答案:
;正确答案:![]() 。
。
(3)乙醇和乙酰氯发生取代反应生成乙酸乙酯和氯化氢,反应③的化学方程式为:![]() ;正确答案:
;正确答案:![]() 。
。
(4)碘遇淀粉显蓝色,判断反应①是否完全,可用碘水检验,A正确;C中含有羟基和羧基,两分子C发生酯化反应生成环状的酯,B正确;葡萄糖、乙醇不与NaOH反应,C错误;酯化反应为醇和酸反应生成酯和水,是取代反应,有机物F为乙醛,不能通过取代反应生成酯;D错误;正确选项AB。

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目