题目内容
1.一定温度下的密闭容器中发生可逆反应2SO2(g)+O2(g)?2SO3(g),不能说明该反应一定达到平衡状态的是( )| A. | SO2的百分含量保持不变 | |
| B. | SO2和SO3的生成速率相等 | |
| C. | 密闭容器中的压强保持不变 | |
| D. | SO2、O2、SO3的物质的量之比为2:1:2 |
分析 当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,据此分析解答.
解答 解:A.当SO2的百分含量保持不变时,该反应中正逆反应速率相等,反应达到平衡状态,故A不选;
B.SO2和SO3的生成速率相等时,则SO2的生成和消耗速率相等,所以反应达到平衡状态,故B不选;
C.该反应是一个反应前后气体物质的量减少的可逆反应,当密闭容器中的压强保持不变时,反应体系中各物质的量不变,则该反应达到平衡状态,故C不选;
D.SO2、O2、SO3的物质的量之比为2:1:2,该反应可能达到平衡状态也可能没有达到平衡状态,与反应物初始物质的量及转化率有关,所以不能据此判断平衡状态,故D选;
故选D.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量不变时可逆反应就达到平衡状态,注意平衡状态判断依据,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
11.下列实验操作中错误的是( )
| A. | 蒸馏操作时,冷凝水的方向应当由下往上 | |
| B. | 分液操作时,首先要打开分液漏斗的上口活塞,然后进行分液 | |
| C. | 提取碘水中的碘单质时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 萃取分液后,要得到被萃取的物质,通常还要进行蒸馏 |
12.下列各组变化中,前者一定包括后者的是( )
| A. | 物理变化、化学变化 | B. | 氧化还原反应、复分解反应 | ||
| C. | 氧化还原反应、置换反应 | D. | 复分解反应、化合反应 |
6.以氯乙烷制1,2-二氯乙烷,下列转化方案中,最好的是( )
| A. | CH3CH2Cl$→_{△}^{NaOH溶液}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2═CH2$\stackrel{Cl_{2}}{→}$CH2ClCH2Cl | |
| B. | CH3CH2Cl$\stackrel{Cl_{2}}{→}$CH2ClCH2Cl | |
| C. | CH3CH2Cl$→_{△}^{NaOH的醇溶液}$CH2═CH2$\stackrel{HCl}{→}$CH3CH2Cl$\stackrel{Cl_{2}}{→}$CH2ClCH2Cl | |
| D. | CH3CH2Cl$→_{△}^{NaOH的醇溶液}$CH2═CH2$\stackrel{Cl_{2}}{→}$CH2ClCH2Cl |
13.对于A2+3B2═2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的为( )
| A. | V(B2)=0.8mol/( L•s) | B. | V(A2)=0.8mol/( L•min) | ||
| C. | V(C)=0.6mol/( L•s) | D. | V(D)=0.8mol/( L•s) |
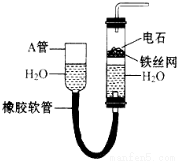 如图装置可以制取乙炔,请填空:
如图装置可以制取乙炔,请填空: