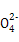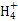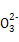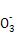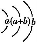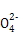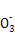题目内容
煤气是生活中常用的燃料,制取水煤气的反应为C(s)+H2O(g) CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是( )
CO(g)+H2(g)。该反应在一容积可变的密闭容器中进行时,改变下列条件会对反应速率产生影响的是( )
①增加碳的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使体系体积增大
A.①② B.②③ C.②④ D.①④
C
【解析】①碳为固体反应物,增加其用量对反应速率几乎无影响;②容器的体积缩小一半相当于压强增大一倍,正、逆反应速率均增大;③体积不变,充入N2使体系压强增大,但反应混合物浓度未改变,反应速率不变;④要想总压强不变,充入N2必然使容器体积增大,导致反应混合物浓度减小,正、逆反应速率均变慢。

根据下列条件计算有关反应的焓变:
(1)已知:Ti(s)+2Cl2(g)=TiCl4(l)ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)=2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)=Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的ΔH=________ kJ·mol-1。
(2)已知下列反应数值:
反应序号 | 化学反应 | 反应热 |
① | Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol- |
③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4=____________ kJ·mol-1。
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
阳离子 | Na+、K+、Cu2+ |
阴离子 | S |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:

(1) M为直流电源的 极,b电极上发生的电极反应为 。
(2)计算e电极上生成的气体在标准状况下的体积为 。
(3)写出乙烧杯中的总反应的离子方程式: 。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量) 。
有关元素X、Y、Z、W的信息如下:
元素 | 有关信息 |
X | 原子半径为0.074 nm,其氢化物的结构模型可表示为: |
Y | 原子半径为0.102 nm,其原子核外电子排布为: |
Z | 人体中必需微量元素中含量最多,体内缺失会引起贫血 |
W | 所在主族序数与所在周期序数之差为4 |
请回答下列问题:
(1)W在元素周期表中的位置是 。
(2)Y与W相比,非金属性较强的是 (填元素符号),下列事实能证明这一结论的是 (填字母)。
a.W元素氢化物的稳定性大于Y元素氢化物的稳定性
b.W元素氢化物水溶液的酸性强于Y元素氢化物水溶液的酸性
c.W元素的单质能与Y元素的氢化物反应,置换出Y单质
d.W的最高价含氧酸比Y的最高价含氧酸的酸性强
(3)Z元素和X元素可形成离子Z ,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
,含该离子的盐是优良的绿色消毒剂和无机絮凝剂。
①Z 具有强氧化性,能杀菌消毒,还原产物是Z3+。
具有强氧化性,能杀菌消毒,还原产物是Z3+。
②含该离子的盐用作絮凝剂的原因是(用离子方程式和简要的文字说明) 。
决定物质性质的重要因素是物质结构,请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1 817 | 2 745 | 11 578 |
B | 738 | 1 451 | 7 733 | 10 540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因 。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
共价键 | C—C | C—N | C—S |
键能/kJ·mol-1 | 347 | 305 | 259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3 401 |
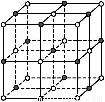
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填序号)。
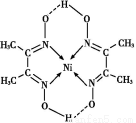
A离子键;B极性键;C金属键;D配位键;E氢键;F非极性键