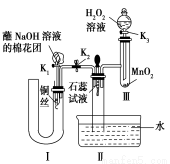
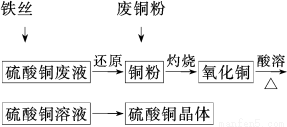
题目内容
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
元素信息
B其单质在常温下为双原子分子,与A可形成分
子X,X的水溶液呈碱性
D其简单阳离子与X具有相同电子数,且是同周
期中简单阳离子中半径最小的
E元素原子最外层比次外层少2个电子
C、F两种元素的原子最外层共有13个电子
则:(1)B的原子结构示意图为 。
(2)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(3)C与D形成的化合物的化学式是 ,它的性质决定了它在物质的分类中应属于 ;请写出该化合物对应水化物电离的方程式 。
(4)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式 。
(1) 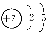
(2)H2O
(3)Al2O3 两性氧化物 Al3++3OH- Al(OH)3
Al(OH)3 AlO2-+H++H2O
AlO2-+H++H2O
(4)氧化 Cl2+SO2+2H2O=4H++2Cl-+SO42-
【解析】A、B,C、D、E、F为短周期主族元素,原子序数依次增大,X的水溶液呈碱性,则A为H,B为N;D的简单阳离子与X的电子数相同,且D是同周期中简单阳离子半径最小的元素,则D为Al;E元素的原子最外层比次外层少2个电子,则E为S,F为Cl;C、F原子最外层电子数共13个,则C为O。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案一定条件下,体积为1 L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)  SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
反应时间/min | n(SiF4)/mol | n(H2O)/mol |
0 | 1.20 | 2.40 |
t1 | 0.80 | a |
t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大