题目内容
设NA是阿伏加德罗常数的数值,下列说法中正确的是。
| A.1 mol Al3+含有的核外电子数为3NA |
| B.1 mol Cl2与足量的铁反应,转移的电子数为3NA |
| C.10 L pH=1的硫酸溶液中含有的H+数为2NA |
| D.10 L pH=13的NaOH溶液中含有的OH-数为NA |
D
解析试题分析:A、选项中Al3+是10电子粒子;B、选项中计算要以Cl2为计算依据;C选项中硫酸已经完全电离,不要重复计算;D选项由pH=13计算OH-浓度为0.1mol/L,则10L NaOH溶液中含有的OH-数为NA,正确。
考点:以阿伏伽德罗常数为背景,考查离子的核外点排布、氧化还原反应中电子转移数目的计算、电解质的电离以及PH的计算。

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,22.4 L H2O含有的分子数为 NA |
| B.28 g N2和N4组成的混合气体中含有的原子数为2 NA |
| C.1 mol·L-1A1Cl3溶液中含有的Cl-数目为3 NA |
| D.2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
NA表示表示阿伏伽德罗常数的值,下列说法正确的是
| A.1mol Na2O2粉末中含离子总数为4NA |
| B.22.4LCO2中含有的原子数为3NA |
| C.1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D.在一定量的稀硝酸中加入56g铁粉且完全溶解,转移的电子一定为3NA |
下列叙述正确的是
| A.1.00mol NaCl中含有6.02×1023个NaCl分子 |
| B.1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 |
| C.欲配制1.00L ,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| D.电解58.5g 熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠 |
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.80mL 10mol 浓盐酸与足量MnO2反应,转移电子数为0.4NA 浓盐酸与足量MnO2反应,转移电子数为0.4NA |
| B.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
| C.1 mol A13+含有核外电子数为3NA |
| D.常温下,16g CH4中共用电子对的数目为4NA |
NA代表阿伏加德罗常数。下列有关NA的叙述中,正确的是( )。
| A.1 mol任何物质所含的分子数均为NA |
| B.14 g氮气所含的氮原子数为NA |
| C.标准状况下,22.4 L水所含的水分子数为NA |
| D.在钠与氯气的反应中,1 mol钠失去电子的数目为2NA |
用NA表示阿伏加德罗常数的值,下列说法中正确的是
| A.2.4g金属镁变为镁离子时失去的电子数为0.2NA |
| B.1mo1·L-1的A1C13溶液中,C1-离子的数目为3 NA |
| C.标准状况下,11.2LH2O含有的分子数为0.5NA |
| D.常温常压下,32g O2和O3的混合气体所含原子数为2.5NA |



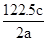
 NH3 + HCl类推NH4NO3
NH3 + HCl类推NH4NO3