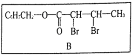
题目内容
【题目】已知![]() 可以和HClO发生氧化还原反应。某学习小组对氯、硫及其化合物的性质进行下列实验探究活动:
可以和HClO发生氧化还原反应。某学习小组对氯、硫及其化合物的性质进行下列实验探究活动:
实验一:探究亚硫酸与次氯酸的酸性强弱。选用的装置和药品如下。
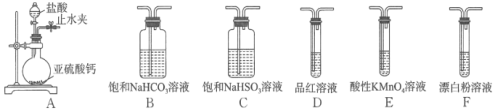
![]() 装置A气密性检查的方法是________。
装置A气密性检查的方法是________。
![]() 装置连接顺序为A、________、B、E、________、F,其中装置E中反应的离子方程式为________,通过现象________即可证明亚硫酸的酸性强于次氯酸。
装置连接顺序为A、________、B、E、________、F,其中装置E中反应的离子方程式为________,通过现象________即可证明亚硫酸的酸性强于次氯酸。
实验二:探究氯气与硫化氢气体混合能发生反应。选用的装置和药品如下。
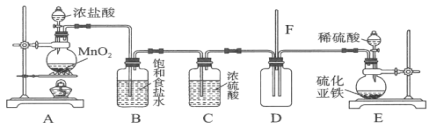
![]() 通过现象________即可证明氯气与硫化氢发生了反应。
通过现象________即可证明氯气与硫化氢发生了反应。
![]() 该装置存在一个不妥之处,你的改进措施为________。
该装置存在一个不妥之处,你的改进措施为________。
实验三:探究氯元素和硫元素非金属性强弱。
![]() 为探究氯元素和硫元素的非金属性强弱,下列实验方案或有关说法中正确的是________。
为探究氯元素和硫元素的非金属性强弱,下列实验方案或有关说法中正确的是________。
A.实验一能说明硫元素非金属性强于氯元素 B.实验二能说明硫元素非金属性弱于氯元素
C.通过测定盐酸和氢硫酸的pH来判断非金属性强弱 D.已知硫化氢的沸点为![]() ,氯化氢的沸点为
,氯化氢的沸点为![]() ,则硫元素非金属性强于氯元素
,则硫元素非金属性强于氯元素
【答案】方法一:塞紧橡胶塞,关闭止水夹,打开分液漏斗活塞,向分液漏斗中加水,一段时间后,水不能顺利流下,则说明装置不漏气
![]() 或方法二:塞紧橡胶塞,关闭分液漏斗活塞,导管末端伸入盛水的烧杯中,用酒精灯微热烧瓶,烧杯中有气泡产生,停止加热,冷却后,导管末端形成一段水柱,且保持一段时间不下降,则说明装置不漏气
或方法二:塞紧橡胶塞,关闭分液漏斗活塞,导管末端伸入盛水的烧杯中,用酒精灯微热烧瓶,烧杯中有气泡产生,停止加热,冷却后,导管末端形成一段水柱,且保持一段时间不下降,则说明装置不漏气![]()
![]() D 5SO2 +2MnO4-+2H2O =2Mn2++5SO42-+4H+ D中品红不褪色,F中出现白色沉淀 装置D中有黄色固体生成 在导管F处连接一盛有碱石灰的尾气吸收装置
D 5SO2 +2MnO4-+2H2O =2Mn2++5SO42-+4H+ D中品红不褪色,F中出现白色沉淀 装置D中有黄色固体生成 在导管F处连接一盛有碱石灰的尾气吸收装置 ![]()
【解析】
(1)可从注水法或气体的热胀冷缩法考虑;
(2)根据题目所给装置,先比较亚硫酸与碳酸酸性,然后利用碳酸的酸性强于次氯酸,从而作出推断;
(3)氯气与硫化氢在装置D中发生反应会生成淡黄色的硫单质;
(4)氯气与硫化氢均有毒,必须有尾气处理装置;
(5)依据非金属性判断的依据来作答。
(1)检验装置气密性方法一:塞紧橡胶塞,关闭止水夹,打开分液漏斗活塞,向分液漏斗中加水,一段时间后,水不能顺利流下,则说明装置不漏气
![]() 或方法二:塞紧橡胶塞,关闭分液漏斗活塞,导管末端伸入盛水的烧杯中,用酒精灯微热烧瓶,烧杯中有气泡产生,停止加热,冷却后,导管末端形成一段水柱,且保持一段时间不下降,则说明装置不漏气
或方法二:塞紧橡胶塞,关闭分液漏斗活塞,导管末端伸入盛水的烧杯中,用酒精灯微热烧瓶,烧杯中有气泡产生,停止加热,冷却后,导管末端形成一段水柱,且保持一段时间不下降,则说明装置不漏气![]() ,
,
故答案为:方法一:塞紧橡胶塞,关闭止水夹,打开分液漏斗活塞,向分液漏斗中加水,一段时间后,水不能顺利流下,则说明装置不漏气
![]() 或方法二:塞紧橡胶塞,关闭分液漏斗活塞,导管末端伸入盛水的烧杯中,用酒精灯微热烧瓶,烧杯中有气泡产生,停止加热,冷却后,导管末端形成一段水柱,且保持一段时间不下降,则说明装置不漏气
或方法二:塞紧橡胶塞,关闭分液漏斗活塞,导管末端伸入盛水的烧杯中,用酒精灯微热烧瓶,烧杯中有气泡产生,停止加热,冷却后,导管末端形成一段水柱,且保持一段时间不下降,则说明装置不漏气![]() ;
;
(2)装置A作用是制取SO2,此装置中SO2含有HCl,HCl干扰实验,必须除去,制出的SO2通入到C装置,然后通入到装置B中,有气泡冒出,说明亚硫酸的酸性强于碳酸,此气体中混有SO2,然后用KMnO4溶液除去SO2,然后再通入品红溶液,检验SO2是否被完全除尽,品红不褪色,说明SO2被完全除尽,通入到F装置中,如果有白色沉淀产生,说明碳酸酸性强于次氯酸,从而得出结论,因此装置的连接顺序是A→C→B→E→D→F,装置B的作用是制取CO2,现象是D中品红溶液不褪色,F中出现白色沉淀,
故答案为:![]() D;5SO2 +2MnO4-+2H2O =2Mn2++5SO42-+4H+;D中品红不褪色,F中出现白色沉淀;
D;5SO2 +2MnO4-+2H2O =2Mn2++5SO42-+4H+;D中品红不褪色,F中出现白色沉淀;
(3)氯气与硫化氢在装置D中发生反应会生成淡黄色的硫单质,则通过观察出D中有淡黄色固体生成来证明氯气与硫化氢发生了反应,
故答案为:装置D中有黄色固体生成;
(4)为防止气体污染环境,需有尾气处理装置,又氯气与硫化氢均为酸性气体,可连接装有碱石灰的尾气处理装置,
故答案为:在导管F处连接一盛有碱石灰的尾气吸收装置;
(5)A. 亚硫酸与次氯酸均不是最高价氧化物对应水化物的酸性,所以不能比较硫与氯的非金属性,A项错误;
B. 氯气与硫化氢反应生成硫与氯化氢,氧化剂为氯气,氧化产物为硫,根据氧化还原反应规律可知氯气的氧化性大于硫,则氯的非金属性强于硫,B项正确;
C. 元素氢化物的酸性强弱不能判断非金属性强弱,C项错误;
D. 沸点为物理性质,不能判断非金属性的强弱,D项错误;
故答案为B。

 名校课堂系列答案
名校课堂系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D