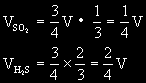题目内容
(1)298K时,向VL真空容器内通入n mol SO2和m mol H2S
①若n=2,则当m=______时,反应后容器内密度最小
②若2n>m,则反应后氧化产物与还原产物的质量差为_____g
③若5n=m,且反应后氧化产物和还原产物的质量和为48g则n+m=______.
(2)在常温常压下,将a L SO2和b L的H2S混合,如反应后气体体积是反应前的1/4,则a和b之比是______.
(3)在常温常压下,向20L真空容器内通过amol H2S 和bmolSO2(a、b都是正整数,且a≤5,b≤5),反应完全后,容器内气体的密度约是14.4g/L,则a∶b=_______.
答案:
解析:
解析:
(1)反应:2H2S+SO2=3S+2H2O ①当n=2、m=4时,恰好完全转化为固体硫,容器内压强最小。 ②当m<2n时,则SO2过量
x=16m ③当m=5n时说明H2S过量。
(3)如若容器内气体是H2S,则它的物质的量应是 14.4g/L×20÷34=8.47(mol) 不符合题意。因H2S物质的量a≤5。则剩余气体应是SO2,SO2物质的量应是14.4×20÷64=4.5mol。则反应的SO2应是0.5mol H2S则是0.5mol×2=1mola∶b=1∶(4.5+0.5)=1∶5
(2)a∶b=1∶1或1∶3 (3)a∶b=1∶5
|

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目