题目内容
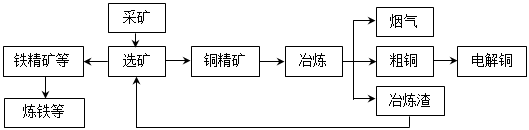
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:

已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
(1)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的名称是 ;
H2O2参加反应的离子方程式为 。
(2)加稀氨水调节pH的目的是 ,pH应调至 范围。下列物质可用来替代稀氨水的是 。
①NaOH ②Fe2O3 ③CuO ④Na2CO3
(3)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精致胆矾。两步操作相同,具体包括 、 、
过滤、 、干燥等步骤。

已知Fe3+、Fe2+ 、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
(1)加入3% H2O2之前必须进行操作Ⅱ,操作Ⅱ的名称是 ;
H2O2参加反应的离子方程式为 。
(2)加稀氨水调节pH的目的是 ,pH应调至 范围。下列物质可用来替代稀氨水的是 。
①NaOH ②Fe2O3 ③CuO ④Na2CO3
(3)经操作Ⅰ得到粗胆矾,操作Ⅲ得到精致胆矾。两步操作相同,具体包括 、 、
过滤、 、干燥等步骤。
(12分,每空2分)(1)冷却(1分); 2Fe2+ + H2O2 + 2H+= 2Fe3+ +2H2O(2分)
(2)使Fe3+完全转变成Fe(OH)3沉淀(2分);3.7~5.2 (2分) ;③(2分)
(4)蒸发浓缩(1分)、降温结晶(1分)、洗涤(1分)
(2)使Fe3+完全转变成Fe(OH)3沉淀(2分);3.7~5.2 (2分) ;③(2分)
(4)蒸发浓缩(1分)、降温结晶(1分)、洗涤(1分)
试题分析:(1)由于双氧水不稳定,加热易分解生成氧气和水。由于在加入双氧水之前溶液的温度较高,所以加入3% H2O2之前必须进行冷却操作。由于亚铁离子沉淀的pH较大,所以必须将其氧化成铁离子沉淀,因此加入双氧水的目的是氧化亚铁离子,反应的离子方程式为2Fe2+ + H2O2 + 2H+= 2Fe3+ +2H2O。
(2)要得到胆矾,就必须除去溶液中的铁离子,则根据沉淀时的pH值可知,调节溶液pH的目的是使Fe3+完全转变成Fe(OH)3沉淀;铁离子完全沉淀时的pH=3.7,而铜离子开始沉淀时的pH=5.2,所以溶液的pH应调节到3.7~5.2之间。由于在调节pH的同时,不能引入杂质,因此应该选择氧化铜来调节溶液的pH,即答案选③。
(3)从溶液中析出胆矾晶体必须通过蒸发浓缩、降温结晶、过滤、洗涤、干燥等操作步骤。

练习册系列答案
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
 CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是( )
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是( )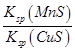
 Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是
Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是