题目内容
常温下,0.1 mol·L-1某一元酸(HA)溶液中 =10-8,下列叙述正确的是
=10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的H+浓度为c(H+)=1.0×10-11 mol·L-1
C.该溶液中水的离子积常数为1.0×10-22
D.在0.1 mol·L-1某一元酸(HA)溶液中,水的电离被促进
【答案】
B
【解析】
试题分析:A、常温下,0.1 mol·L-1某一元酸(HA)溶液中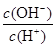 =10-8,则根据水的离子积常数可知,溶液中c(OH-)=
=10-8,则根据水的离子积常数可知,溶液中c(OH-)=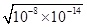 =10-11,因此溶液中氢离子浓度=10-3mol/L,则溶液的pH=3,A不正确;B、酸抑制水的电离,则该溶液中由水电离出的c(H+)=溶液中c(OH-)=1.0×10-11
mol·L-1,B正确;C、水的离子积常数只与温度有关系,温度不变,水的离子积常数不变,因此该溶液中水的离子积常数为1.0×10-14,C不正确;D、根据水的电离方程式H2O
=10-11,因此溶液中氢离子浓度=10-3mol/L,则溶液的pH=3,A不正确;B、酸抑制水的电离,则该溶液中由水电离出的c(H+)=溶液中c(OH-)=1.0×10-11
mol·L-1,B正确;C、水的离子积常数只与温度有关系,温度不变,水的离子积常数不变,因此该溶液中水的离子积常数为1.0×10-14,C不正确;D、根据水的电离方程式H2O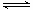 H++OH-可知酸抑制水的电离,D不正确,答案选B。
H++OH-可知酸抑制水的电离,D不正确,答案选B。
考点:考查pH、水的离子积常数计算以及外界条件对水电离平衡的影响

练习册系列答案
相关题目