题目内容
(2011?平顶山二模)马尔氏盐A为浅蓝绿色结晶,是一种重要的化学试剂,可用作聚合催化剂.A的溶液具有以下转化关系:回答下列问题:
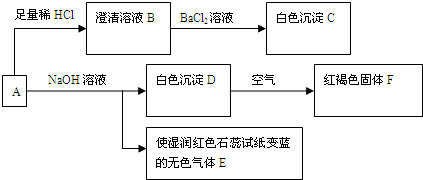
(1)白色沉淀C的化学式为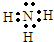
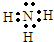 .
.
(2)由D转化成为F的化学反应方程式为
(3)称取一定量A的晶体,经测定其结晶水含量约为27.6%.将其完全溶于水配成溶液,经过上述转化最多可得到的C和F的物质的量之比为2:1.由此可确定A的化学式为
(4)上述转化关系中,若用稀硝酸代替稀盐酸,
(5)A的标准溶液,常用于标定高锰酸钾溶液等.请写出在高锰酸钾溶液中滴加A的标准溶液时,所发生的离子反应方程式,并标明电子转移情况.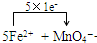 +8H+=5Fe3++Mn2++4H2O
+8H+=5Fe3++Mn2++4H2O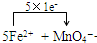 +8H+=5Fe3++Mn2++4H2O.
+8H+=5Fe3++Mn2++4H2O.

(1)白色沉淀C的化学式为
BaSO4
BaSO4
,无色气体E的电子式为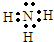
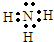
(2)由D转化成为F的化学反应方程式为
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(3)称取一定量A的晶体,经测定其结晶水含量约为27.6%.将其完全溶于水配成溶液,经过上述转化最多可得到的C和F的物质的量之比为2:1.由此可确定A的化学式为
(NH4)2Fe( SO4)2?6H2O
(NH4)2Fe( SO4)2?6H2O
.(4)上述转化关系中,若用稀硝酸代替稀盐酸,
不能
不能
(填“能”或“不能”)通过该转化关系确定A的组成,理由是因为不能确定它是硫酸盐还是亚硫酸盐
因为不能确定它是硫酸盐还是亚硫酸盐
.要准确称出C的质量,需要重复进行干燥、冷却、称量的操作,目的是彻底除去C表面的水分
彻底除去C表面的水分
.(5)A的标准溶液,常用于标定高锰酸钾溶液等.请写出在高锰酸钾溶液中滴加A的标准溶液时,所发生的离子反应方程式,并标明电子转移情况.
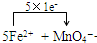 +8H+=5Fe3++Mn2++4H2O
+8H+=5Fe3++Mn2++4H2O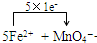 +8H+=5Fe3++Mn2++4H2O
+8H+=5Fe3++Mn2++4H2O分析:马尔氏盐A为浅蓝绿色结晶,A即和酸反应也可以和碱反应,与碱反应生成白色沉淀和使湿润的红色石蕊试纸变蓝的气体是氨气,说明A中含铵根离子;白色沉淀在空气中放置生成红褐色沉淀,说明是氢氧化铁;所以D为氢氧化亚铁;说明A含有亚铁离子,A和足量盐酸反应得到澄清溶液B,加入氯化钡溶液生成白色沉淀,说明A中含有硫酸根离子.
解答:解:A即和酸反应也可以和碱反应,与碱反应生成白色沉淀和使湿润的红色石蕊试纸变蓝的气体是氨气,说明A中含铵根离子;白色沉淀在空气中放置生成红褐色沉淀,说明是氢氧化铁;所以D为氢氧化亚铁;说明A含有亚铁离子,A和足量盐酸反应得到澄清溶液B,加入氯化钡溶液生成白色沉淀,说明A中含有硫酸根离子;马尔氏盐A为浅蓝绿色结晶则含有的离子为铵根离子、亚铁离子、硫酸根离子;推断出物质分别为:A、含有铵根离子、亚铁离子、硫酸根离子;B、含硫酸根离子的溶液,C、BaSO4;D、4Fe(OH)2 E、NH3 F、Fe(OH)3
(1)依据推断白色沉淀C为:BaSO4,无色气体E是氨气,氨气的电子式为: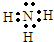 ;故答案为:BaSO4
;故答案为:BaSO4 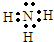 ;
;
(2)D是Fe(OH)2转化成为FFe(OH)3的化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)称取一定量A的晶体,经测定其结晶水含量约为27.6%.将其完全溶于水配成溶液,经过上述转化最多可得到的BaSO4和Fe(OH)3的物质的量之比为2:1.说明A中含硫酸根离子子和亚铁离子2:1,依据化合物化合价代数和为0,则铵根离子:亚铁离子:硫酸根离子=2:1:2,(NH4)2Fe(SO4)2 ,设马尔氏盐A化学式为:(NH4)2Fe(SO4)2 ?xH2O,A的晶体,经测定其结晶水含量约为27.6%,
×100%=27.6%,x=6;所以A的化学式为:(NH4)2Fe(SO4)2 ?6H2O;故答案为:(NH4)2Fe(SO4)2 ?6H2O;
(4)若用稀硝酸代替稀盐酸,硝酸具有强氧化性,不能确定铁元素的存在状态,不能通过该转化关系确定A的组成,因为不能确定它是硫酸盐还是亚硫酸盐;要准确称出C(BaSO4)的质量,需要重复进行干燥、冷却、称量的操作,目的是彻底除去C(BaSO4)表面的水分;
故答案为:不能;因为不能确定它是硫酸盐还是亚硫酸盐;目的是彻底除去C(BaSO4)表面的水分;
(5)高锰酸钾溶液中滴加A(:(NH4)2Fe(SO4)2 ?6H2O)的标准溶液时,高锰酸钾溶液氧化A中的 亚铁离子发生氧化还原反应,反应的离子方程式为: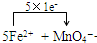 +8H+=5Fe3++Mn2++4H2O,
+8H+=5Fe3++Mn2++4H2O,
故答案为: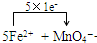 +8H+=5Fe3++Mn2++4H2O.
+8H+=5Fe3++Mn2++4H2O.
(1)依据推断白色沉淀C为:BaSO4,无色气体E是氨气,氨气的电子式为:
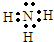 ;故答案为:BaSO4
;故答案为:BaSO4 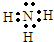 ;
;(2)D是Fe(OH)2转化成为FFe(OH)3的化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)称取一定量A的晶体,经测定其结晶水含量约为27.6%.将其完全溶于水配成溶液,经过上述转化最多可得到的BaSO4和Fe(OH)3的物质的量之比为2:1.说明A中含硫酸根离子子和亚铁离子2:1,依据化合物化合价代数和为0,则铵根离子:亚铁离子:硫酸根离子=2:1:2,(NH4)2Fe(SO4)2 ,设马尔氏盐A化学式为:(NH4)2Fe(SO4)2 ?xH2O,A的晶体,经测定其结晶水含量约为27.6%,
| xH2O |
| (NH4)2Fe(SO4)2?xH2O |
(4)若用稀硝酸代替稀盐酸,硝酸具有强氧化性,不能确定铁元素的存在状态,不能通过该转化关系确定A的组成,因为不能确定它是硫酸盐还是亚硫酸盐;要准确称出C(BaSO4)的质量,需要重复进行干燥、冷却、称量的操作,目的是彻底除去C(BaSO4)表面的水分;
故答案为:不能;因为不能确定它是硫酸盐还是亚硫酸盐;目的是彻底除去C(BaSO4)表面的水分;
(5)高锰酸钾溶液中滴加A(:(NH4)2Fe(SO4)2 ?6H2O)的标准溶液时,高锰酸钾溶液氧化A中的 亚铁离子发生氧化还原反应,反应的离子方程式为:
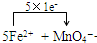 +8H+=5Fe3++Mn2++4H2O,
+8H+=5Fe3++Mn2++4H2O,故答案为:
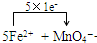 +8H+=5Fe3++Mn2++4H2O.
+8H+=5Fe3++Mn2++4H2O.点评:本题考查了物质转化关系,物质性质的应用,主要考查铁及其化合物的性质判断和性质应用,物质化学式的确定方法,氧化还原反应的电子转移表示方法,实验注意问题的熟练掌握,题目较难.

练习册系列答案
相关题目
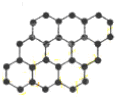 (2011?平顶山二模)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
(2011?平顶山二模)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( ) 2CH3OH+3O2+4OH-,则下列说法正确的是( )
2CH3OH+3O2+4OH-,则下列说法正确的是( )