题目内容
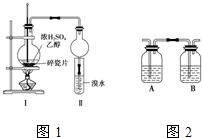 某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.
某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.(1)写出该实验中生成乙烯的化学方程式:
C2H5OH
CH2=CH2↑+H2O
| 浓硫酸 |
| 170℃ |
C2H5OH
CH2=CH2↑+H2O
| 浓硫酸 |
| 170℃ |
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是
BC
BC
A、乙烯与溴水易发生取代反应?
B、使溴水褪色的反应,未必是加成反应?
C、使溴水褪色的物质,未必是乙烯?
D、反应中有乙醚生成,也会使溴水褪色?
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是
试管底层有油状物质生成
试管底层有油状物质生成
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加图2装置,则A中的试剂应为
氢氧化钠溶液
氢氧化钠溶液
; B中的试剂为品红
品红
,其作用是检验SO2是否除尽
检验SO2是否除尽
.分析:(1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃;
(2)浓H2SO4具有强氧化性,能将乙醇氧化成碳,根据SO2具有还原性,也能与溴水反应使溴水褪色,据此即可解答;
(3)溴水中的溴与乙烯发生加成反应;
(4)在Ⅰ和Ⅱ之间增加图2装置,A装置是为了除去SO2和CO2,B装置是为了检验SO2是否除尽.
(2)浓H2SO4具有强氧化性,能将乙醇氧化成碳,根据SO2具有还原性,也能与溴水反应使溴水褪色,据此即可解答;
(3)溴水中的溴与乙烯发生加成反应;
(4)在Ⅰ和Ⅱ之间增加图2装置,A装置是为了除去SO2和CO2,B装置是为了检验SO2是否除尽.
解答:解:(1)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,CH3CH2OH
CH2=CH2↑+H2O;
故答案为:CH3CH2OH
CH2=CH2↑+H2O;
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,并且可以进一步反应,C+2H2SO4
CO2↑+2SO2↑+2H2O
SO2具有还原性,可以与Br2反应,SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,故答案为:BC;
(3)溴水中的溴与乙烯发生加成反应,即CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷在试管底层为油状物质,
故答案为:试管底层有油状物质生成;
(4)A装置是为了除去SO2,可用NaOH溶液,B装置是为了检验SO2是否除尽,可用品红溶液,
故答案为:氢氧化钠溶液;品红;检验SO2是否除尽.
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
(2)浓H2SO4具有强氧化性,将乙醇氧化成碳,并且可以进一步反应,C+2H2SO4
| ||
SO2具有还原性,可以与Br2反应,SO2+Br2+2H2O=2HBr+H2SO4,所以BC正确,故答案为:BC;
(3)溴水中的溴与乙烯发生加成反应,即CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷在试管底层为油状物质,
故答案为:试管底层有油状物质生成;
(4)A装置是为了除去SO2,可用NaOH溶液,B装置是为了检验SO2是否除尽,可用品红溶液,
故答案为:氢氧化钠溶液;品红;检验SO2是否除尽.
点评:本题主要以实验形式考查了乙烯的化学性质,掌握乙烯的实验室制法是解答的关键,题目难度不大.

练习册系列答案
相关题目
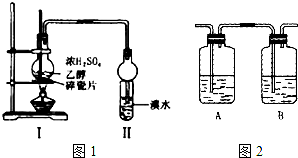 某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.





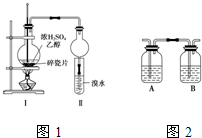 某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.
某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.