题目内容
Na2O2与CO2反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2
(1)Na2O2显
(2)Na2O2在反应中作用
(1)Na2O2显
淡黄
淡黄
色,其中氧元素的化合价呈-1
-1
价;(2)Na2O2在反应中作用
c
c
(选择下列序号:a.氧化剂,b.还原剂,c.既作氧化剂、又作还原剂);若产生标准状况下22.4L氧气,则消耗Na2O2156
156
g,转移电子的物质的量是2
2
mol.分析:(1)Na2O2是淡黄色的固体;Na的化合价为+1价,再根据化合价代数和为零价来计算;
(2)在2Na2O2+2CO2=2Na2CO3+O2中,过氧化钠中氧元素的化合价是-1价,碳酸钠中氧元素的化合价是-2价,氧气中氧元素的化合价是0价,所以该反应过氧化钠中既有氧元素化合价升高也有化合价降低,过氧化钠既表现氧化性也表现还原性;
根据氧化还原反应方程式2Na2O2+2CO2=2Na2CO3+O2及氧气的体积进行计算消耗Na2O2的质量;
根据失去电子的元素和得到电子的元素及转移的电子总数来标出电子转移的方向和数目及氧气的体积进行计算转移电子的物质的量.
(2)在2Na2O2+2CO2=2Na2CO3+O2中,过氧化钠中氧元素的化合价是-1价,碳酸钠中氧元素的化合价是-2价,氧气中氧元素的化合价是0价,所以该反应过氧化钠中既有氧元素化合价升高也有化合价降低,过氧化钠既表现氧化性也表现还原性;
根据氧化还原反应方程式2Na2O2+2CO2=2Na2CO3+O2及氧气的体积进行计算消耗Na2O2的质量;
根据失去电子的元素和得到电子的元素及转移的电子总数来标出电子转移的方向和数目及氧气的体积进行计算转移电子的物质的量.
解答:解:(1)Na2O2是淡黄色的固体;Na的化合价为+1价,所以氧的化合价为-1价,故答案为:淡黄;-1;
(2)在2Na2O2+2CO2=2Na2CO3+O2中,过氧化钠中氧元素的化合价是-1价,碳酸钠中氧元素的化合价是-2价,氧气中氧元素的化合价是0价,所以该反应过氧化钠中既有氧元素化合价升高也有化合价降低,过氧化钠既表现氧化性也表现还原性,
标准状况下22.4L氧气的物质的量为1mol,
2Na2O2 +2CO2=2Na2CO3 +O2
2 1
2mol 1mol
消耗Na2O2的质量为0.2mol×78g/mol=156g;
在 2Na2O2+2CO2═2Na2CO3+O2反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,用双线桥法可表示为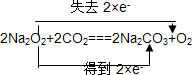 ,由2Na2O2+2CO2=2Na2CO3+O2~2e-可知,生成1molO2时,转移的电子数为1mol×2=2mol;
,由2Na2O2+2CO2=2Na2CO3+O2~2e-可知,生成1molO2时,转移的电子数为1mol×2=2mol;
故答案为:c;156;2.
(2)在2Na2O2+2CO2=2Na2CO3+O2中,过氧化钠中氧元素的化合价是-1价,碳酸钠中氧元素的化合价是-2价,氧气中氧元素的化合价是0价,所以该反应过氧化钠中既有氧元素化合价升高也有化合价降低,过氧化钠既表现氧化性也表现还原性,
标准状况下22.4L氧气的物质的量为1mol,
2Na2O2 +2CO2=2Na2CO3 +O2
2 1
2mol 1mol
消耗Na2O2的质量为0.2mol×78g/mol=156g;
在 2Na2O2+2CO2═2Na2CO3+O2反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,用双线桥法可表示为
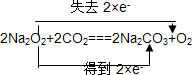 ,由2Na2O2+2CO2=2Na2CO3+O2~2e-可知,生成1molO2时,转移的电子数为1mol×2=2mol;
,由2Na2O2+2CO2=2Na2CO3+O2~2e-可知,生成1molO2时,转移的电子数为1mol×2=2mol;故答案为:c;156;2.
点评:本题考查氧化还原反应以及化学计算,题目难度不大,解答该类题目的关键是能把握元素的化合价的变化.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目