题目内容
20.A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物.请回答下列问题:(1)A、B、C、D、E分别是(填元素符号)H,N,O,Na,S.
(2)C和E两种元素相比较,非金属性较强的是(填元素名称)氧,可以验证该结论的是(填写字母)BC;
A.比较这两种元素的常见单质是沸点 B.比较这两种元素的单质与氢气化合的难易 C.比较这两种元素的气态氢化物的稳定性
(3)A、C、D、E可形成两种酸式盐(均有四种元素组成),两种酸式盐相互反应的离子方程式为HSO3-+H+=SO2↑+H2O.
(4)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为HS-+OH-=S2-+H2O.
分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H元素;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N元素;D与A同主族,D原子序数大于氮,故D为Na;D与E同周期,则E处于第三周期,E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,最外层电子数为6,故E为S元素;结合原子序数可知,C为O、F元素中的一种,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物,可推知C为O元素,据此解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H元素;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N元素;D与A同主族,D原子序数大于氮,故D为Na;D与E同周期,则E处于第三周期,E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,最外层电子数为6,故E为S元素;结合原子序数可知,C为O、F元素中的一种,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物,可推知C为O元素.
(1)由上述分析可知,A、B、C、D、E分别是(填元素符号):H、N、O、Na、S,故答案为:H、N、O、Na、S;
(2)同主族自上而下原子得电子能力减弱,故非金属性O>S,
A.单质的沸点属于物理性,不能比较非金属性强弱,故A错误;
B.元素非金属性越强,单质与氢气反应越容易,故B正确;
C.氢化物稳定性与元素非金属性一致,故C正确,
故答案为:氧;BC;
(3)A、C、D、E可形成两种酸式盐为NaHSO3和NaHSO4,离子反应为HSO3-+H+=SO2↑+H2O,
故答案为:HSO3-+H+=SO2↑+H2O;
(4)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,离子反应为HS-+OH-=S2-+H2O,故答案为:HS-+OH-=S2-+H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意理解掌握元素金属性、非金属性比较.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 9% | B. | 18% | C. | 36% | D. | 72% |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 积极开发氢能源 | B. | 充分利用太阳能 | C. | 不使用化石燃料 | D. | 积极开发核能源 |
| A. | 钋是一种银白色金属,能在黑暗中发光 | |
| B. | 钋的原子核内有210个中子 | |
| C. | 钋-210原子中中子数与核外电子数之差为126 | |
| D. | 钋-210的摩尔质量为210g |
 氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其工作原理如图所示.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该电池工作时化学能转化为电能 | |
| B. | 该电池的总反应为:2H2+O2═2H2O | |
| C. | 该电池中电极b是正极 | |
| D. | 外电路中电子由电极b通过导线流向电极a |
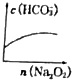
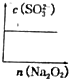
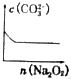
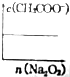
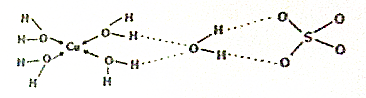
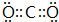 ;一种由E、D组成的化合物与AD2互为等电子体,其化学式为N2O.
;一种由E、D组成的化合物与AD2互为等电子体,其化学式为N2O.