题目内容
下列各分子中,所有原子都满足最外层为8电子结构的是
| A.H2O | B.BF3 | C.PCl5 | D.CCl4 |
D
解析试题分析:只要分子中元素化合价的绝对值与最外层电子数之和等于8,即可以满足满足最外层为8电子结构,据此可以判断。A、水中的H和O的化合价分别是+1价和-2价,因此氢元素不能满足最外层为8电子结构,氧元素满足,A不正确;B、BF3中B和F的化合价分别是+3价和-1价,则B元素不能满足最外层为8电子结构,F元素满足,B不正确;C、PCl5中P和Cl的化合价分别是+5价和-1价,则P元素不能满足最外层为8电子结构,Cl元素满足,C不正确;D、四氯化碳中C和Cl的化合价分别是+4价和-1价,均满足最外层为8电子结构,D正确,答案选D。
考点:考查8电子稳定结构的判断

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
重水 是重要的核工业原料,下列关于D原子的说法错误的是
是重要的核工业原料,下列关于D原子的说法错误的是
A.氘 原子核外有1个电子 原子核外有1个电子 | B.是H的同位素 |
| C.自然界中没有D原子存在 | D. 质量数为2 质量数为2 |
R为短周期元素,其原子所具有的电子层数为最外层电子数的一半。下列说法中不正确的是
| A.当它形成含氧酸根离子R2O42—时,也可以形成RO32— |
| B.当它形成含氧酸根离子RO42—时,还可以形成HRO3— |
| C.当它形成含氧酸根离子RO4—时,还可以形成RO3— |
| D.当它形成含氧酸根离子R2O72—时,也可以形成RO42— |
A的原子结构示意图为: ,其基态原子的价电子层电子排布式正确的是
,其基态原子的价电子层电子排布式正确的是
| A.3s23p2 | B.3d24s2 | C.4s24p2 | D.3s23p4 |
人们对原子结构的认识有一个不断深入的过程,下列先后顺序中符合史实的是
①道尔顿提出的原子论 ②卢瑟福的原子结构行星模型
③波尔提出的原子力学模型 ④汤姆生提出的葡萄干面包原子模型
| A.①④②③ | B.①②④③ | C.②①④③ | D.①③②④ |
短周期元素W、X、Y和Z的原子序数依次增大。金属W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y的单质是常见的金属,可做海洋电池的负极材料。Z原子的质子数是同主族上一周期原子质子数的2倍。下列说法正确的是( )
| A.由金属W制备的高效电池可用NH4Cl溶液作电解质 |
| B.元素X与氢形成的化合物中不可能既有极性健又有非极性健 |
| C.元素Y、Z分别形成的简单离子,后者的离子半径较前者大 |
| D.元素Y、Z的最高价氧化物对应的水化物之间不能反应 |
根据下表信息,判断以下叙述正确的是( )
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.单质与稀盐酸反应的速率为L<Q
C.氢化物的热稳定性为H2T<H2R
D.氢化物的沸点为H2T<H2R
下列关于粒子结构的描述不正确的是( )
| A.H2S和NH3均是价电子总数为8的极性分子 |
| B.HS-和HCl均是含有一个极性键的18电子粒子 |
| C.CH2Cl2和CCl4均是四面体构型的非极性分子 |
D.1 mol 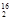 DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) |