题目内容
下列叙述正确的是
| A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
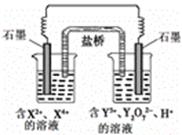
B.下图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液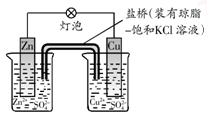 |
| C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H+ +4e-=2H2O |
| D.电镀时,通常把待镀的金属制品作阳极 |
AC
试题分析:A、在海轮外壳连接锌块,锌比铁活泼,所以锌被腐蚀,铁被保护,正确;B、原电池装置中阴离子移向电池的负极,所以盐桥中的Cl-移向ZnSO4溶液,错误;C、氢氧燃料电池中正极发生还原反应,所以在正极通入的是氧气,电极反应为O2+4H+ +4e-=2H2O,正确;D、电镀时把待镀金属制品作阴极,镀层金属作阳极,镀层离子作电解质溶液,错误,答案选AC。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目