题目内容
一块表面已被氧化为氧化钠的金属钠1.08g,投入200g过量的水中,放出氢气224mL(标准状况),同时测得反应后所得溶液的体积为200mL,则反应后所得溶液中溶质的物质的量浓度为( )A.0.5mol?L-1
B.0.4 mol?L-1
C.0.3 mol?L-1
D.0.2 mol?L-1
【答案】分析:先根据反应2Na+2H2O=2NaOH+H2↑计算样品中Na的质量;进而计算Na2O的质量,再利用钠元素守恒计算生成NaOH的总物质的量,根据c=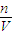 计算氢氧化钠的浓度.
计算氢氧化钠的浓度.
解答:解:标准状况下放出224mLH2的物质的量为: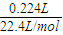 =0.01mol,则:
=0.01mol,则:
2Na+2H2O=2NaOH+H2↑
46g 1mol
m(Na) 0.01mol
故m(Na)=46g× =0.46g,
=0.46g,
原混合物中金属钠的质量为1.08g,则m(Na2O)=1.08g-0.46g=0.62g,
n(Na)=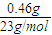 =0.02mol,n(Na2O)=
=0.02mol,n(Na2O)=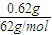 =0.01mol,
=0.01mol,
根据钠元素守恒可知生成NaOH的总物质的量为n(NaOH)=0.02mol+0.01mol×2=0.04mol,c(NaOH)=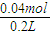 =0.2mol/L,
=0.2mol/L,
故选D.
点评:本题考查混合物的计算、钠及其化合物性质,题目难度不大,注意有关反应方程式的书写,根据Na元素质量守恒计算.
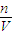 计算氢氧化钠的浓度.
计算氢氧化钠的浓度.解答:解:标准状况下放出224mLH2的物质的量为:
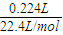 =0.01mol,则:
=0.01mol,则:2Na+2H2O=2NaOH+H2↑
46g 1mol
m(Na) 0.01mol
故m(Na)=46g×
 =0.46g,
=0.46g,原混合物中金属钠的质量为1.08g,则m(Na2O)=1.08g-0.46g=0.62g,
n(Na)=
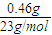 =0.02mol,n(Na2O)=
=0.02mol,n(Na2O)=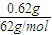 =0.01mol,
=0.01mol,根据钠元素守恒可知生成NaOH的总物质的量为n(NaOH)=0.02mol+0.01mol×2=0.04mol,c(NaOH)=
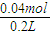 =0.2mol/L,
=0.2mol/L,故选D.
点评:本题考查混合物的计算、钠及其化合物性质,题目难度不大,注意有关反应方程式的书写,根据Na元素质量守恒计算.

练习册系列答案
相关题目
一块表面已被氧化为Na2O的钠块10.8g,将其投入100g水中,产生H2 0.2g,则被氧化的钠是 ( )
| A.9.2g | B.10.6g | C.6.2g | D.4.6g |