题目内容
4.合成水杨酸某酯E的路线如下: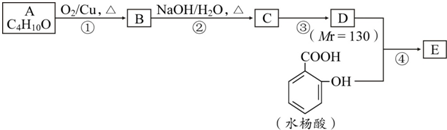
已知:①;

②A分子中有3个亚甲基(-CH2-).
(1)C中含有官能团的名称为碳碳双键、-CHO;③的反应类型为加成反应或还原反应.
(2)确定A中含有B的试剂为Ag(NH3)2OH或Cu(OH)2(填化学式);D的结构简式为
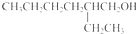 .
.(3)A的同类物质的同分异构体M在Cu和加热条件下不能被O2氧化,则M的名称(系统命名法)为2-甲基-2-丙醇.
(4)水杨酸在一定条件下可以形成高分子化合物,写出此反应的化学方程式:
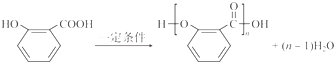 .
.(5)下列有关说法正确的是ac(填序号).
a.B的核磁共振氢谱有4组吸收峰
b.水杨酸与足量NaHCO3反应生成
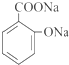
c.E的分子式为C15H22O3
d.1mol E与足量浓溴水反应,最多消耗3mol Br2.
分析 A的分子式为C4H10O,A分子中有3个亚甲基(-CH2-),则A的结构简式为CH3CH2CH2CH2OH,A在Cu作催化剂、加热条件下被氧化生成B,据已知反应和反应条件可知,B结构简式为CH3CH2CH2CHO,1-丁醛在NaOH/H2O条件下发生加成生成C,结合题中信息可知,C结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,C反应生成D,E为水杨酸酯,根据图中转化关系知,D中含有醇羟基,且D相对分子质量为130,则D结构简式为CH3CH2CH2CH2CH(CH2CH3)CH2OH,C和氢气发生加成反应生成D,D和邻羟基苯甲酸发生酯化反应生成E,E结构简式为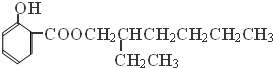 ,据此分析解答.
,据此分析解答.
解答 解:A的分子式为C4H10O,A分子中有3个亚甲基(-CH2-),则A的结构简式为CH3CH2CH2CH2OH,A在Cu作催化剂、加热条件下被氧化生成B,据已知反应和反应条件可知,B结构简式为CH3CH2CH2CHO,1-丁醛在NaOH/H2O条件下发生加成生成C,结合题中信息可知,C结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,C反应生成D,E为水杨酸酯,根据图中转化关系知,D中含有醇羟基,且D相对分子质量为130,则D结构简式为CH3CH2CH2CH2CH(CH2CH3)CH2OH,C和氢气发生加成反应生成D,D和邻羟基苯甲酸发生酯化反应生成E,E结构简式为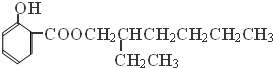 ,
,
(1)通过以上分析知,C结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,含有碳碳双键和醛基,C和氢气发生加成反应生成D,
故答案为:碳碳双键、-CHO;加成反应(或还原反应);
(2)A为丁醇,B为丁醛,确定醇中含有醛可用新制氢氧化铜或银氨溶液,C结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,C反应生成D,E为水杨酸酯,根据图中转化关系知,D中含有醇羟基,且D相对分子质量为130,则D结构简式为CH3CH2CH2CH2CH(CH2CH3)CH2OH,
故答案为:Ag(NH3)2OH或Cu(OH)2;CH3CH2CH2CH2CH(CH2CH3)CH2OH;
(3)A为正丁醇,其同类物质的同分异构体M在Cu和加热条件下不能被O2氧化,说明连羟基的C原子上没有H原子,应为2-甲基-2-丙醇,故答案为:2-甲基-2-丙醇;
(4)水杨酸中含有羧基和羟基,能够通过酯化反应发生缩聚生成高分子化合物,化学方程式为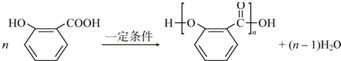 ,
,
故答案为: ;
;
(5)a.B为正丁醛,有4种氢原子,所以B的核磁共振氢谱有4组吸收峰,故a正确;
b.水杨酸与足量NaHCO3反应生成 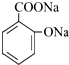 ,酚羟基不能够与碳酸氢钠反应,故b错误;
,酚羟基不能够与碳酸氢钠反应,故b错误;
c.E结构简式为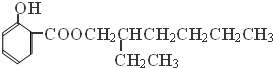 ,E的分子式为C15H22O3,故c正确;
,E的分子式为C15H22O3,故c正确;
d.E结构简式为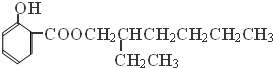 ,酚羟基的邻对位能够与Br发生取代反应,所以1mol E与足量浓溴水反应,最多消耗2mol Br2,故d错误;故答案为:ac.
,酚羟基的邻对位能够与Br发生取代反应,所以1mol E与足量浓溴水反应,最多消耗2mol Br2,故d错误;故答案为:ac.
点评 本题考查有机物的推断,侧重考查学生分析推断能力及知识迁移能力,正确推断出A物质是解本题关键,结合题给信息进行分析解答,注意反应前后物质结构差异性,题目难度中等.

| A. | 向次氯酸钙溶液通过量CO2:Ca2++2C1O-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 碘水中通入足量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ | |
| C. | FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+═2Fe3++2H2O | |
| D. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+═3I2+3H2O |
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)( 填“>”、“<”或“=”).
(3)已知25℃时,酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
CH3COOH+Na2CO3(少量):2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
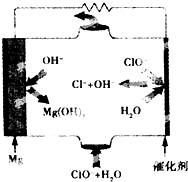 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 池总反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| B. | 正极反应式为ClO-+H2O+2e-=Cl-+2OH- | |
| C. | 该燃料电池中镁为负极,发生还原反应电 | |
| D. | 放电过程中OH-移向负极 |
| A. | 使用清洁能源是防止酸雨发生的重要措施之一 | |
| B. | CO2、CH4、N2等均是造成温室效应的气体 | |
| C. | 节能减排符合低碳经济的要求 | |
| D. | 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |
 最难
最难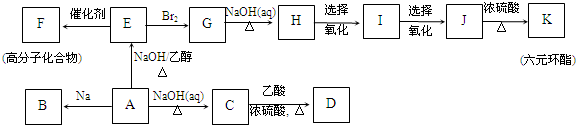
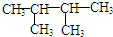 ,K为
,K为 ;
;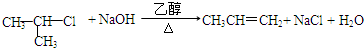 ;G→H
;G→H ;
; .
.