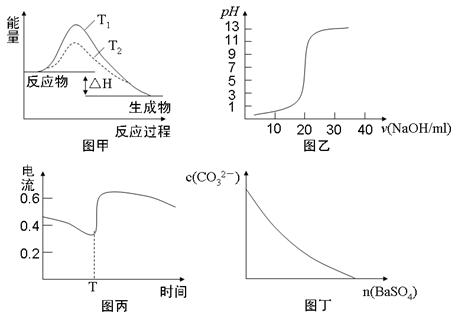
题目内容
按要求写出下列方程
(1)碳酸钠溶液呈碱性的原因,用离子方程表示 。
(2)用锌保护海底钢铁设施,其中负极发生的电极反应为: 。
(3)含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式 。
(4)氢氧化镁溶解在浓的氯化铵溶液,用离子方程表示 。
(5) Al(OH)3的电离反应方程式: 。
(1)碳酸钠溶液呈碱性的原因,用离子方程表示 。
(2)用锌保护海底钢铁设施,其中负极发生的电极反应为: 。
(3)含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则表示该反应中和热的热化学方程式 。
(4)氢氧化镁溶解在浓的氯化铵溶液,用离子方程表示 。
(5) Al(OH)3的电离反应方程式: 。
(1)CO32-+H2O HCO3-+OH- (2)Zn-2e-=Zn2+
HCO3-+OH- (2)Zn-2e-=Zn2+
(3)NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
(4)Mg(OH)2+2NH4+=2NH3·H2O+Mg2+ (5)H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
 HCO3-+OH- (2)Zn-2e-=Zn2+
HCO3-+OH- (2)Zn-2e-=Zn2+(3)NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol
(4)Mg(OH)2+2NH4+=2NH3·H2O+Mg2+ (5)H++AlO2-+H2O
 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-试题分析:(1)碳酸钠是强碱弱酸盐,溶于水电离出的CO32-水解,溶液显碱性,离子方程式为CO32-+H2O
 HCO3-+OH-。
HCO3-+OH-。(2)锌的金属性强于铁,与铁构成原电池时锌是负极失去电子,被氧化。铁是正极,被保护,负极反应式为Zn-2e-=Zn2+。
(3)20.0 g NaOH的物质的量=20.0g÷40.0g/mol=0.5mol,与足量的盐酸反应生成0.5mol水,因此生成1mol水时放出的热量是28.7 kJ×2=57.4kJ。又因为中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ/mol。
(4)氯化铵溶液中NH4+水解溶液显酸性,因此可以溶解氢氧化镁,反应的离子方程式为Mg(OH)2+2NH4+=2NH3·H2O+Mg2+。
(5)氢氧化铝是弱电解质,属于两性氢氧化物存在两种电离平衡,酸式电离和碱式电离,因此其电离方程式为H++AlO2-+H2O
 Al(OH)3
Al(OH)3 Al3++3OH-。
Al3++3OH-。
练习册系列答案
相关题目



 C(g)ΔH1=-Q1 kJ/mol
C(g)ΔH1=-Q1 kJ/mol 2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
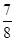 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
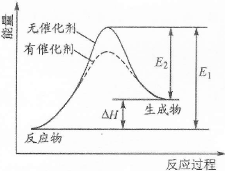
 )、环己二烯(
)、环己二烯( )和苯的氢化热数据。
)和苯的氢化热数据。

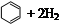

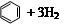
 转变为
转变为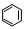 时放热
时放热