题目内容
【题目】大多数化学反应都存在“能垒”(活化能),下列反应可以认为不存在“能垒”的是
A. 甲烷的燃烧 B. 溶液中的H+与OH-的反应
C. 氢气与氯气化合 D. 铝热反应
【答案】B
【解析】
活化能是指分子从常态转变为容易发生化学反应的活跃状态所需要的能量。
A甲烷和氧气在常态时不容易反应,要反应必须提供能量,使之达到活跃状态,故A存在“能垒”;
B.溶液中的H+与OH-的反应,无需提供能量,常温就能反应,本身就是活跃状态,故B不存在“能垒”;
C.氢气与氯气化合,常太不反应,只有见光或加热才能反应,故C存在“能垒”;
D,铝热反应只有在高温时才能反应,故D存在“能垒”;
本题答案为B。

【题目】化学实验是进行化学研究的有效方法,请回答下列实验中的有关问题。
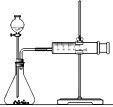
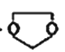
I.用如图所示的装置测定中和热。

实验药品:100mL 0.50 molL-1盐酸、100mL 0.55 molL-1NaOH溶液。
实验步骤:略。
回答下列问题:
(1)从实验装置上看,还缺少环形玻璃搅拌棒,该装置的作用是____________;有同学提议可以用铜质搅拌棒替代,你是否赞同(说明理由)________________。
(2)你认为该实验成功的关键是______________________________。
II.影响化学反应速率的因素很多,某校课外兴趣小组用实验的方法进行探究。甲、乙两个兴趣小组利用Mg、Fe、Cu和不同浓度的硫酸(0.5 molL-1、2 molL-1、18.4 molL-1),设计实验方案来研究影响反应速率的因素。
(1)请帮助甲小组完成研究的实验报告:
实 验 步 骤 | 现 象 | 结 论 |
①分别取等体积0.5 molL-1硫酸于试管中 ②分别投入大小、形状相同的Mg、Fe、Cu ③观察金属表面产生气体的快慢 | ①产生气体的速率Mg>Fe ②Cu上无气体产生 | _________ |
根据控制变量法,要得出正确的实验结论,在实验过程中需要保持温度和压强相同。
(2)乙小组为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。该小组选用的实验药品是:Fe、2molL-1硫酸和______molL-1硫酸。