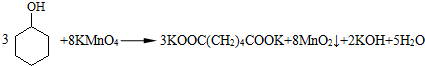题目内容
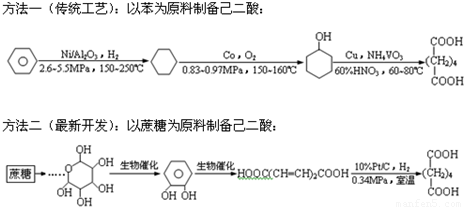
己二酸是合成尼龙6,6的原料.据统计我国每年的需求量均在几十万吨以上.现有两种合成方法:

与传统工艺相比,关于方法二的优点,下列描述你认为正确的是:(1)原料(植物资源)来源广泛 (2)原料无毒无害 (3)反应在温和条件进行而不使用高压设备 (4)生产过程中对环境的危害小 (5)生产过程中只需要生物催化剂 (6)工艺简单,产率高( )

与传统工艺相比,关于方法二的优点,下列描述你认为正确的是:(1)原料(植物资源)来源广泛 (2)原料无毒无害 (3)反应在温和条件进行而不使用高压设备 (4)生产过程中对环境的危害小 (5)生产过程中只需要生物催化剂 (6)工艺简单,产率高( )
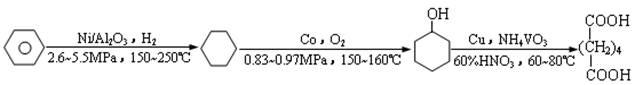
分析:对比方法一、二,方法二原料为蔗糖,来源广泛,反应在生物催化或室温、低压下进行,生产工艺较为简单,对环境的危害较小.
解答:解:方法二原料为蔗糖,来源广泛,并且无毒,则(1)(2)正确;
反应在生物催化或室温、低压下进行,生产工艺较为简单,则(3)(4)(6)正确;
方法二不全部使用生物催化剂,由 可知(5)错误,
可知(5)错误,
故选C.
反应在生物催化或室温、低压下进行,生产工艺较为简单,则(3)(4)(6)正确;
方法二不全部使用生物催化剂,由
 可知(5)错误,
可知(5)错误,故选C.
点评:本题考查有机物合成途径的方案评价,题目难度中等,注意比较二者所用原料以及反应的机理.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下:
(2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下: