题目内容
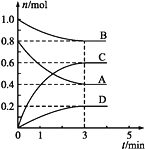
【题目】T ℃时,在容积为0.5 L的密闭容器中发生如下反应:mA(g)+nB(g)![]() pC(g)+qD(s) ΔH<0(m、n、p、q为最简整数比)。A、B、C、D的物质的量变化如图所示。
pC(g)+qD(s) ΔH<0(m、n、p、q为最简整数比)。A、B、C、D的物质的量变化如图所示。
(1)写出该反应的化学方程式:______________________
(2) T ℃时,该反应的平衡常数K=____。
(3)反应达到平衡后,下列措施对A的转化率无影响的是____(填选项字母)。
A.升高温度
B.移走一部分D
C.把容器的体积减小一半
(4) T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)____(填“>”“<”或“=”)v(逆),判断的依据是______________________。
【答案】 2A(g)+B(g)![]() 3C(g)+D(s) 1.69 BC =
3C(g)+D(s) 1.69 BC = ![]() =1.69=K
=1.69=K
【解析】考查化学反应速率的计算、化学平衡的计算,(1)根据同容器中化学反应速率之比等于化学计量数之比,等于物质的量的变化,m:n:p:q=(0.8-0.4):(1-0.8):0.6:0.2=2:1:3:1,因此反应方程式为:2A(g)+B(g)![]() 3C(g)+D(s) ;(2)根据平衡常数的表达式,K= c3(C)//[c2(A)×c(B)]=0.63/[0.42×0.8]=1.69;(3)a、化学反应不是放热反应,就是吸热反应,升高温度,平衡一定发生改变,A的转化率发生改变,故a错误;b、D的状态为固体,浓度视为常数,移走一部分D,平衡不移动,A的转化率不变,故B正确;C、反应前后气体系数之和相等,容器的体积减小一半,平衡不移动,A的转化率不变,故C正确;(4)根据Qc=
3C(g)+D(s) ;(2)根据平衡常数的表达式,K= c3(C)//[c2(A)×c(B)]=0.63/[0.42×0.8]=1.69;(3)a、化学反应不是放热反应,就是吸热反应,升高温度,平衡一定发生改变,A的转化率发生改变,故a错误;b、D的状态为固体,浓度视为常数,移走一部分D,平衡不移动,A的转化率不变,故B正确;C、反应前后气体系数之和相等,容器的体积减小一半,平衡不移动,A的转化率不变,故C正确;(4)根据Qc=![]() =1.69=K,平衡不移动,v(正)=v(逆)。
=1.69=K,平衡不移动,v(正)=v(逆)。

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案