题目内容
【题目】某同学在实验室将13gZn投入足量稀硫酸中充分反应制取H2,同时得到100g密度为1.25 g/mL的溶液。请计算
(1)可制得标准状况下H2的体积为________L。
(2)所得溶液中硫酸锌的物质的量浓度为________________ mol/L。
(3)从所得溶液中取出一半,加入0.15mol的BaCl2恰好使硫酸根离子沉淀完全,求原所得溶液中H+物质的量浓度为______________ mol/L。
【答案】 4.48 2.5 2.5
【解析】(1)由锌与足量盐酸反应方程式计量数可知,n(Zn)=n(H2)=n(ZnSO4)=13g/65g/mol=0.2mol,可制得标准状况下H2的体积为![]() ;(2)c((ZnSO4)= n(ZnSO4)/V=
;(2)c((ZnSO4)= n(ZnSO4)/V= 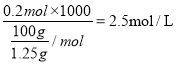 ;(3)从所得溶液中取出一半,加入0.15mol的BaCl2恰好使硫酸根离子沉淀完全,即硫酸钡的物质的量0.15mol,因锌与硫酸反应时,硫酸根未参与反应,则原硫酸溶液中硫酸的物质的量为0.3mol,又因n(ZnSO4)=0.2mol,说明有0.2mol硫酸参与反应在,还有0.1mol硫酸未参与反应,则未参与反应氢离子的物质的量为0.2mol,原所得溶液中H+物质的量浓度为
;(3)从所得溶液中取出一半,加入0.15mol的BaCl2恰好使硫酸根离子沉淀完全,即硫酸钡的物质的量0.15mol,因锌与硫酸反应时,硫酸根未参与反应,则原硫酸溶液中硫酸的物质的量为0.3mol,又因n(ZnSO4)=0.2mol,说明有0.2mol硫酸参与反应在,还有0.1mol硫酸未参与反应,则未参与反应氢离子的物质的量为0.2mol,原所得溶液中H+物质的量浓度为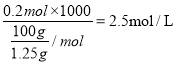 。
。

练习册系列答案
相关题目
