题目内容
日常所用的锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O.下列有关锌-锰干电池的叙述中不正确的是( )
分析:锌-锰干电池属于原电池,根据电极反应式知,锌失电子作负极,二氧化锰得电子发生还原反应,所以二氧化锰发生反应的电极碳棒作正极,电流从正极沿导线流向负极.
解答:解:A.锌失电子作负极,石墨作正极,电流从正极石墨经外电路流向负极锌,故A正确;
B.该电池中锌易失电子生成锌离子而逐渐溶解,故B正确;
C.金属材料在碱性电解质中比在酸性电解质中的稳定性提高,所以若用湿的KOH替代电解质NH4Cl,可延长电池寿命和提高电池性能,故C正确;
D.干电池属于一次电池,所以不能实现化学能与电能的相互转化,故D错误;
故选D.
B.该电池中锌易失电子生成锌离子而逐渐溶解,故B正确;
C.金属材料在碱性电解质中比在酸性电解质中的稳定性提高,所以若用湿的KOH替代电解质NH4Cl,可延长电池寿命和提高电池性能,故C正确;
D.干电池属于一次电池,所以不能实现化学能与电能的相互转化,故D错误;
故选D.
点评:本题考查原电池原理,根据原电池正负极上得失电子来分析解答即可,难度不大.

练习册系列答案
相关题目
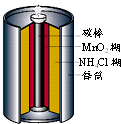 如图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )
如图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是( )
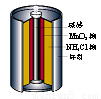
 A.电池内部含有电解质
A.电池内部含有电解质