题目内容
(8分)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。
(1)下列有关说法正确的是 ▲ 。
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
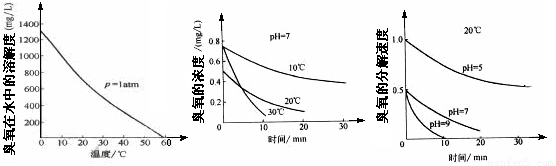
(2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气, 臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:
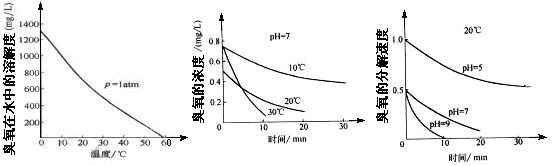
用臭氧消毒自来水,适宜的条件是 ▲ 。
(3)2O3(g) →3O2(g) △H=-285kJ/mol, 2Ag2O(s) = 4Ag(s)+ O2(g)△H=62.2 kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为: ▲ 。
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式: ▲ 。
(1) ABCD
(2) 低温,水的pH控制7或弱碱性
(3) 6Ag(s) + O3(g) = 3Ag2O(s) △H=-235.8kJ/mol
(4) CH3CH = CHCH3 + 2O3→2CH3CHO + 2O2
(每空2分,共8分)

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案(8分)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。
(1)下列有关说法正确的是 ▲ 。
| A.停止使用氟里昂是为保护臭氧层 |
| B.光化学烟雾与大气臭氧的生成有关 |
| C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒 |
| D.臭氧能使湿润的碘化钾-淀粉试纸变蓝 |

用臭氧消毒自来水,适宜的条件是 ▲ 。
(3)2O3(g) →3O2(g) △H=-285kJ/mol, 2Ag2O(s) =" 4Ag(s)+" O2(g)△H="62.2" kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为: ▲ 。
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式: ▲ 。
 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH