题目内容
下列有关电解质溶液中微粒的物质的量浓度关系不正确的是( )
| A、在0.1 mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、向0.2 mol?L-1 NaHCO3溶液中加入等体积0.1 mol?L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol?L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.碳酸氢钠溶液呈碱性,说明HCO3-的水解程度大于电离程度,但都较微弱;
B.溶液中存在质子守恒,根据质子守恒判断;
C.二者混合后溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度大于碳酸氢根离子水解程度,混合溶液呈碱性;
D.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断c(Na+)、c(CH3COO-)相对大小,溶液中存在部分醋酸,其浓度大于溶液中氢离子浓度.
B.溶液中存在质子守恒,根据质子守恒判断;
C.二者混合后溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度大于碳酸氢根离子水解程度,混合溶液呈碱性;
D.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒判断c(Na+)、c(CH3COO-)相对大小,溶液中存在部分醋酸,其浓度大于溶液中氢离子浓度.
解答:
解:A.碳酸氢钠溶液呈碱性,说明HCO3-的水解程度大于电离程度,但都较微弱,钠离子不水解,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),故A正确;
B.溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B正确;
C.二者混合后溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度大于碳酸氢根离子水解程度,所以c(CO32-)<c(HCO3-),故C错误;
D.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(CH3COO-),溶液中存在部分醋酸,其浓度大于溶液中氢离子浓度,所以溶液中离子浓度大小顺序是c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故D正确;
故选C.
B.溶液中存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故B正确;
C.二者混合后溶液中的溶质为等物质的量浓度的NaHCO3和Na2CO3,碳酸根离子水解程度大于碳酸氢根离子水解程度,所以c(CO32-)<c(HCO3-),故C错误;
D.混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(Na+)=c(CH3COO-),溶液中存在部分醋酸,其浓度大于溶液中氢离子浓度,所以溶液中离子浓度大小顺序是c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-),故D正确;
故选C.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及溶液酸碱性、溶质的性质即可解答,再结合守恒思想分析,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列溶液中,一定能大量共存的离子组是( )
| A、能使氢氧化铝迅速溶解的溶液:Na+、Fe2+、NO3-、SO42- |
| B、能使酚酞试液变红的溶液:Na+、NH4+、CO32-、SO42- |
| C、含有大量SO42-的透明溶液:K+、Cu2+、Cl-、NO3- |
| D、含有大量ClO-的溶液:H+、Mg2+、I-、SO42- |
下列各反应的能量变化分别用如下形式的示意图表示,其中正确的是( )
A、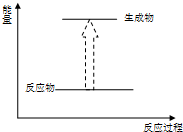 化石燃料的燃烧 |
B、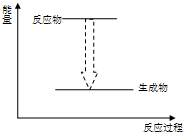 植物的光合作用 |
C、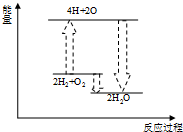 氢气与氧气反应 |
D、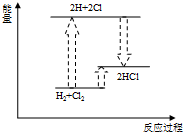 氢气与氯气反应 |
下列离子方程式书写正确的是( )
| A、NH4Cl溶液与苏打溶液混合:2NH4++CO32-═2NH3↑+CO2↑+H2O | ||||
| B、向Mg(OH)2沉淀中加入FeCl3溶液:3Mg(OH)2+2Fe3+═3Mg2++2Fe(OH)3 | ||||
C、用石墨作电极电解AlCl3溶液:2Cl-+2H2O
| ||||
| D、FeCl3溶液与Na2SO3溶液混合:2Fe3++3SO32-+3H2O═2Fe(OH)3↓+3SO2↑ |
将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,该有机物的一氯代物有几种( )
| A、1 | B、3 | C、4 | D、5 |
己烯雌酚是一种激素类药物,结构如下,下列有关叙述中不正确的是( )


| A、可与NaOH和NaHCO3发生反应 |
| B、1mol该有机物可以与7mol H2发生反应 |
| C、可以用有机溶剂萃取 |
| D、1mol该有机物可以与5mol Br2发生反应 |
同位素在化学反应机理的研究中有着重要的作用.下列有关乙酸乙酯水解的化学方程式不正确的是( )
| A、CH3COOCH2CH3+HOD→CH3COOD+CH3CH2OH |
| B、CH3COOCH2CH3+HOD→CH3COOH+CH3CH2OD |
| C、CH3CO18OCH2CH3+H2O→CH3CO18OH+CH3CH2OH |
| D、CH3C18OOC H2CH3+H2O→CH3C18OOH+CH3CH2OH |
气体甲(中学常见)通入溶液乙中,随着甲的通入,溶液乙的颜色逐渐褪去,加热褪色后的溶液不再恢复原来的颜色.下列说法正确的是( )
| A、气体甲一定不是SO2 |
| B、气体甲一定是Cl2 |
| C、气体甲一定不是发生了化合反应 |
| D、气体甲一定被溶液乙氧化 |