题目内容
电石是重要的工业原料,电石渣[主要成分Ca(OH)2]的综合利用体现了绿色化学思想。
(1)用电石为原料可生产聚氯乙烯。聚氯乙烯的结构简式为____________。
(2)电石渣可用于除去垃圾焚烧炉烟道气中的SO2生成CaSO4,反应中的氧化剂是____________ (填名称)。
(3)电石渣可用于生产纯碱。涉及的部分化学反应为:
(i)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(ii)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
此生产过程中,可循环利用的物质有____________ (填化学式)。
(4)用电石渣处理酸性含铬(Cr2O72—)电镀废水的流程如下: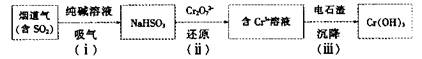
①步骤(i)发生反应的化学方程式为__________________
②步骤(ii)发生反应的离子方程式为__________________
③步骤(iii)调节溶液pH为8,则残留Cr3+的浓度为______(Ksp[Cr(OH)3]=6.3×10—31)。
(15分)(1) (2分)
(2分)
(2)氧气(2分)
(3)NH3、CO2、H2O(各1分,共3分)
(4)①2SO2+Na2CO3+H2O=2NaHSO3+CO2(3分)
②3HSO3—+Cr2O72—+5H+=3SO42—+2Cr3++4H2O(3分)
③6.3×10—13molL(漏写单位扣1分,共2分)
解析试题分析:(1)略;(2)电石渣的主要成分是氢氧化钙、碳酸钙等,SO2被吸收后变为亚硫酸钙,然后被空气中的氧气氧化为硫酸钙;(3)碳酸钙热分解生成CaO、CO2,CaO与水反应生成Ca(OH)2,共四步反应中,NH3、CO2、H2O可以循环利用;(4)①亚硫酸的酸性比碳酸强,则吸气步骤反应式为2SO2+Na2CO3+H2O=2NaHSO3+CO2;根据电子、电荷、原子守恒可知,还原步骤反应式为3HSO3—+Cr2O72—+5H+=3SO42—+2Cr3++4H2O;常温下pH=8,则c(OH—)=Kw/c(H+)=10—6mol/L,Cr(OH)3(s) Cr3+(aq)+3OH—(aq),Ksp[Cr(OH)3]=c(Cr3+)?c3(OH—)=6.3×10—31,则c(Cr3+)=6.3×10—13mol/L。
Cr3+(aq)+3OH—(aq),Ksp[Cr(OH)3]=c(Cr3+)?c3(OH—)=6.3×10—31,则c(Cr3+)=6.3×10—13mol/L。
考点:考查结构简式的书写、氧化剂、绿色化学理念、化学方程式、离子方程式、溶度积的计算等相关知识。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案化学已渗透人类生活的各个方面。下列说法不正确的是
| A.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
| B.“光化学烟雾”、“自氧空洞”的形成都与氮氧化合物有关 |
| C.低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
| D.高铁酸钾(K2FeO4)是新型高效多功能水处理剂,既能消毒杀菌又能净水 |
化学与生活息息相关,下列说法正确的是
| A.蔗糖、钡餐(硫酸钡)和水分别属于弱电解质、强电解质和非电解质 |
| B.淀粉、油脂和蛋白质都是高分子化合物 |
| C.用食醋可除去热水壶内壁的水垢 |
| D.光导纤维是将太阳能转化为电能的常用材料 |
下列能源转化过程中,污染较大的是
| A.风能发电 | B.燃煤发电 | C.地热能发电 | D.太阳能发电 |
化学与生活、生产、环境等社会实际密切相关。下列叙述正确的是( )
| A.稀的食盐水能杀死H7N9禽流感病毒 |
| B.涤纶、塑料、光导纤维都是有机高分子材料 |
| C.用电镀厂的废水直接灌溉农田,可提高水的利用率 |
| D.外形似海绵、密度小、有磁性的碳与石墨互为同素异形体 |
下列说法不正确的是
| A.2013年1月1日起,我省正式发布环境空气质量指数(AQI),包括PM2.5、PM10、O3、CO2、SO2和NO2等6项指标 |
| B.核磁共振仪、红外光谱仪、紫外光谱仪、质谱仪等都可用于有机化合物结构的分析 |
| C.石油裂解、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化 |
| D.维勒打破了无机物和有机物的界限,卢瑟福提出了带核的原子结构模型 |
 Si3N4+6CO。Si3N4属于 晶体,在上述反应中氧化剂为 。
Si3N4+6CO。Si3N4属于 晶体,在上述反应中氧化剂为 。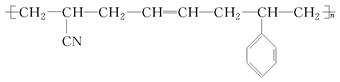
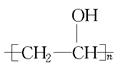 )和聚丙烯酸盐(
)和聚丙烯酸盐( )交联得到,从结构上看该高分子吸水材料具有吸水性,原因为它们都具有 基团。
)交联得到,从结构上看该高分子吸水材料具有吸水性,原因为它们都具有 基团。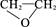 )的反应中,原子利用率最高的是
)的反应中,原子利用率最高的是