题目内容
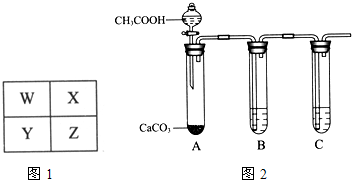 W、X、Y、Z为四种短周期主族元素,其位置关系如图1.
W、X、Y、Z为四种短周期主族元素,其位置关系如图1.(1)若X原子的最外层电子数是次外层的3倍.
①元素X在周期表中的位置
②工业上由W的单质制备W的气态氢化物的化学方程式是
(2)若四种元素中只有一种金属元素.
①冶炼Y的化学方程式是
②工业上,将X的单质与Z的最高价氧化物加热到1900℃以上可制得一种新型陶瓷(ZX),同时得到一种可燃性气体,该反应的化学方程式是
③为比较X、Z最高价氧化物的水化物酸性强弱,某同学设计如图2所示实验.
I.B试管中盛放的试剂是
II.C试管中反应的化学方程式是
分析:(1)这几种元素为短周期元素,根据元素在周期表中的位置知,W和X为第二周期元素,若X原子的最外层电子数是次外层的3倍,X的最外层电子数为6,次外层电子数是2,则X为O元素,W为N元素,Y为P元素,Z为S元素,结合元素在周期表中的位置及物质之间的反应解答;
(2)若四种元素中只有一种金属元素,这几种元素为短周期元素,W和Y为第IIIA族元素,W为B元素、Y为Al元素、X为C元素、Z为Si元素,
①活泼金属采用电解其氧化物或熔融盐的方法冶炼;
②根据元素守恒知,生成的气体中含有氧元素,且该气体能燃烧,则为CO,根据反应物、生成物及反应条件写出方程式;
③I.氯化氢也能和硅酸钠反应而造成干扰,所以要除去二氧化碳中的氯化氢;
II.二氧化碳和硅酸钠反应生成硅酸和碳酸钠.
(2)若四种元素中只有一种金属元素,这几种元素为短周期元素,W和Y为第IIIA族元素,W为B元素、Y为Al元素、X为C元素、Z为Si元素,
①活泼金属采用电解其氧化物或熔融盐的方法冶炼;
②根据元素守恒知,生成的气体中含有氧元素,且该气体能燃烧,则为CO,根据反应物、生成物及反应条件写出方程式;
③I.氯化氢也能和硅酸钠反应而造成干扰,所以要除去二氧化碳中的氯化氢;
II.二氧化碳和硅酸钠反应生成硅酸和碳酸钠.
解答:解:(1)这几种元素为短周期元素,根据元素在周期表中的位置知,W和X为第二周期元素,若X原子的最外层电子数是次外层的3倍,X的最外层电子数为6,次外层电子数是2,则X为O元素,W为N元素,Y为P元素,Z为S元素,
①X原子核外有2个电子层,最外层电子数为6,原子核外电子层数等于周期数,主族元素最外层电子数等于其族序数,所以X位于第2周期VIA族,
故答案为:第2周期VIA族;
②在高温高压、催化剂条件下,氮气和氢气反应生成氨气,反应方程式为:3H2+N2
2NH3,
故答案为:3H2+N2
2NH3;
(2)若四种元素中只有一种金属元素,这几种元素为短周期元素,W和Y为第IIIA族元素,W为B元素、Y为Al元素、X为C元素、Z为Si元素,
①铝属于活泼金属,氯化铝为分子晶体,其熔融状态不导电,工业上采用电解氧化铝的方法冶炼铝,方程式为:2Al2O3
4Al+3O2↑,故答案为:2Al2O3
4Al+3O2↑;
②根据元素守恒知,生成的气体中含有氧元素,且该气体能燃烧,则为CO,该反应方程式为:3C+SiO2
SiC+2CO↑,故答案为:3C+SiO2
SiC+2CO↑;
③I.醋酸和碳酸钙反应生成二氧化碳,但盐酸具有挥发性,导致二氧化碳中有氯化氢气体,氯化氢也和硅酸钠溶液反应而对二氧化碳造成干扰,所以二氧化碳和硅酸钠溶液反应之前要除去氯化氢气体,为防止引进杂质和减少二氧化碳的量,B中盛放碳酸氢钠溶液,故答案为:饱和NaHCO3溶液;
II.二氧化碳和水反应生成碳酸,碳酸和硅酸钠发生复分解反应生成硅酸和碳酸钠,反应方程式为Na2SiO3+CO2+H2O═Na2SiO3+Na2CO3,
故答案为:Na2SiO3+CO2+H2O═Na2SiO3+Na2CO3.
①X原子核外有2个电子层,最外层电子数为6,原子核外电子层数等于周期数,主族元素最外层电子数等于其族序数,所以X位于第2周期VIA族,
故答案为:第2周期VIA族;
②在高温高压、催化剂条件下,氮气和氢气反应生成氨气,反应方程式为:3H2+N2
| ||
| 高温高压 |
故答案为:3H2+N2
| ||
| 高温高压 |
(2)若四种元素中只有一种金属元素,这几种元素为短周期元素,W和Y为第IIIA族元素,W为B元素、Y为Al元素、X为C元素、Z为Si元素,
①铝属于活泼金属,氯化铝为分子晶体,其熔融状态不导电,工业上采用电解氧化铝的方法冶炼铝,方程式为:2Al2O3
| ||
| 冰晶石 |
| ||
| 冰晶石 |
②根据元素守恒知,生成的气体中含有氧元素,且该气体能燃烧,则为CO,该反应方程式为:3C+SiO2
| ||
| ||
③I.醋酸和碳酸钙反应生成二氧化碳,但盐酸具有挥发性,导致二氧化碳中有氯化氢气体,氯化氢也和硅酸钠溶液反应而对二氧化碳造成干扰,所以二氧化碳和硅酸钠溶液反应之前要除去氯化氢气体,为防止引进杂质和减少二氧化碳的量,B中盛放碳酸氢钠溶液,故答案为:饱和NaHCO3溶液;
II.二氧化碳和水反应生成碳酸,碳酸和硅酸钠发生复分解反应生成硅酸和碳酸钠,反应方程式为Na2SiO3+CO2+H2O═Na2SiO3+Na2CO3,
故答案为:Na2SiO3+CO2+H2O═Na2SiO3+Na2CO3.
点评:本题考查了无机物的推断,根据元素在周期表中的位置及物质的性质来分析解答,涉及金属的冶炼、实验方案设计、酸性强弱的判断等知识点,根据金属的活泼性确定金属的冶炼方法,根据强酸制取弱酸确定酸性强弱,题目难度中等.

练习册系列答案
相关题目
 的2倍;元素是地壳中含量最多的元素;Z元素是短周期中原子半径最大的元素。回答下列问题:
的2倍;元素是地壳中含量最多的元素;Z元素是短周期中原子半径最大的元素。回答下列问题: