题目内容
在实验室里制取的乙烯中常混有少量二氧化硫.某化学课外小组设计了如图所示实验,以确认上述混合气体中含有乙烯和二氧化硫.请填写下列空白:
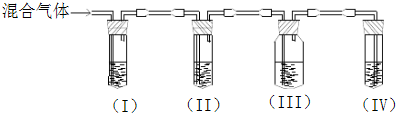
(1)能说明SO2气体存在的现象是______.
(2)使用装置Ⅱ的目的是______;有关反应的离子方程式是______.
(3)使用装置Ⅲ的目的是______.
(4)确定含有乙烯的现象是______;乙烯与溴水反应的化学方程式为______.

(1)能说明SO2气体存在的现象是______.
(2)使用装置Ⅱ的目的是______;有关反应的离子方程式是______.
(3)使用装置Ⅲ的目的是______.
(4)确定含有乙烯的现象是______;乙烯与溴水反应的化学方程式为______.
乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),二氧化硫是否存在可用品红溶液检验.乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净.最后用高锰酸钾酸性溶液褪色实验检验乙烯;
(1)二氧化硫是否存在可用品红溶液检验,品红溶液褪色说明含有二氧化硫,
故答案为:装置Ⅰ中品红溶液褪色;
(2)乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色,二氧化硫的存在影响乙烯的检验,故检验乙烯时应先除去二氧化硫,有关反应的离子方程式是SO2+Br2+H2O═4H++SO42-+2Br-,
故答案为:除去二氧化硫气体,以免干扰乙烯的实验,SO2+Br2+H2O═4H++SO42-+2Br-;
(3)通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,
故答案为:检验二氧化硫是否除尽;
(4)最后用高锰酸钾酸性溶液褪色实验检验乙烯,装置Ⅳ中的酸性高锰酸钾溶液褪色,说明含有乙烯;乙烯与溴水发生加成反应的方程式:CH2=CH2+Br2→CH2BrCH2Br
故答案为:装置Ⅲ中的品红溶液不褪色,装置Ⅳ中的酸性高锰酸钾溶液褪色,CH2=CH2+Br2→CH2Br-CH2Br.
(1)二氧化硫是否存在可用品红溶液检验,品红溶液褪色说明含有二氧化硫,
故答案为:装置Ⅰ中品红溶液褪色;
(2)乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色,二氧化硫的存在影响乙烯的检验,故检验乙烯时应先除去二氧化硫,有关反应的离子方程式是SO2+Br2+H2O═4H++SO42-+2Br-,
故答案为:除去二氧化硫气体,以免干扰乙烯的实验,SO2+Br2+H2O═4H++SO42-+2Br-;
(3)通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,
故答案为:检验二氧化硫是否除尽;
(4)最后用高锰酸钾酸性溶液褪色实验检验乙烯,装置Ⅳ中的酸性高锰酸钾溶液褪色,说明含有乙烯;乙烯与溴水发生加成反应的方程式:CH2=CH2+Br2→CH2BrCH2Br
故答案为:装置Ⅲ中的品红溶液不褪色,装置Ⅳ中的酸性高锰酸钾溶液褪色,CH2=CH2+Br2→CH2Br-CH2Br.

练习册系列答案
相关题目