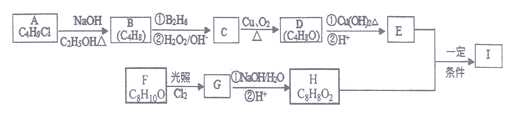
题目内容
【题目】铅及其化合物用途非常广泛,已知铅(Pb)与硅同主族且Pb比Si多3个电子层。回答下列问题:
(1)铅位于元素周期表的第__________周期__________族。
(2)难溶物PbSO4溶于CH3COONH4溶液可制得(CH3COO)2Pb [(CH3COO)2Pb易溶于水],发生的反应为 PbSO4+2CH3COONH4=(CH3COO)2Pb +(NH4)2SO4,说明(CH3COO)2Pb是_______(填“强”或“弱”)电解质。
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O,其中工作“B”为________(填“放电”或“充电”);电解质不能用浓盐酸,否则电池失效并放出大量的氯气,其原因是________(用化学方程式表示)。
2PbSO4+2H2O,其中工作“B”为________(填“放电”或“充电”);电解质不能用浓盐酸,否则电池失效并放出大量的氯气,其原因是________(用化学方程式表示)。
(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中,揽拌后溶液显紫红色。则每反应1 molMn(NO3)2,转移______________mol电子。
【答案】 六 IVA 弱 充电 PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O 5
【解析】(1)铅位于元素周期表的第六周期IVA族。(2)从PbSO4+2CH3COONH4=(CH3COO)2Pb +(NH4)2SO4可以得出(CH3COO)2Pb比PbSO4更难电离,故(CH3COO)2Pb是弱电解质;(3)B从PbSO4变成Pb和PbO2,恢复成电池的电极材料,故B是充电;电解质不能用浓盐酸,浓酸具有还原性,PbO2具有强氧化性,能将Cl―氧化成Cl2,发生的反应为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O;(4)将PbO2加入硝酸酸化的Mn(NO3)2溶液中,揽拌后溶液显紫红色。说明Mn2+ 被氧化成MnO4―,升高5价,则每反应1 molMn(NO3)2,转移5mol电子。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】用如图所示装置及表中的药品(装置I中的试剂足量)并依据装置Ⅱ中的现象,检验混合气体中的某种成分,方案合理的是( )
选项 | 实验目的 | 装置Ⅰ中的试剂 | 装置Ⅱ中的试剂 |
|
A | 检验CO2中混有的CH4 | 澄清石灰水 | 溴水 | |
B | 检验H2S中混有的SO2 | 酸性KMnO4溶液 | 品红溶液 | |
C | 检验溴蒸气中混有的NO2 | CC14 | 石蕊试液 | |
D | 检验HI中混有的HCl | 饱和食盐水 | AgNO3溶液 |
A. A B. B C. C D. D