题目内容
氮氧化合物是大气污染的重要因素。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为 (填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G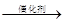 N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是 (填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应的离子方程式为: 。
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为: (选填“A”或“B”),阴极反应式为: 。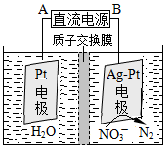
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为 (填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G
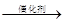 N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。下列化合物中,满足上述反应式中的G是 (填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应的离子方程式为: 。
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为: (选填“A”或“B”),阴极反应式为: 。

(1)N2+O2 2NO
2NO
(2)-574.1
(3)还原剂,ad
(4)①2 NO3-+5H2 N2+2OH-+4H2O
N2+2OH-+4H2O
②A 2 NO3-+12 H++10e-=N2↑+6H2O
 2NO
2NO(2)-574.1
(3)还原剂,ad
(4)①2 NO3-+5H2
 N2+2OH-+4H2O
N2+2OH-+4H2O②A 2 NO3-+12 H++10e-=N2↑+6H2O
试题分析:(1)汽车中电火花引燃,N2在放电条件下发生反应生成一氧化氮;(2)将第二个反应减去第一个反应得到C(s)+2NO(g)=CO2(g)+N2(g),故ΔH=(-393.5-180.6)kJ·mol-1(3)NO2变成无害的N2发生还原反应,NO2做氧化剂,故G做还原剂;NO2和G反应后有水生成,故G中应含有H,排除b、c,a和d都具有还原性,可做还原剂,故选a、d;(4)①用H2将NO还原为N2,H2中的氢被氧化成+1价,根据溶液碱性明显增强,说明有OH-生成,根据电荷守恒、原子守恒和氧化还原的配平方法写出方程式;②NO还原为N2,发生还原反应,为阴极,故B为电源的负极,A为电源正极;NO还原为N2,故2mol NO得10mol电子生成1mol N2,在酸性条件下O结合氢离子生成水,从而写出阴极的电极反应式。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
 2CO+O2
2CO+O2 2CH3OH+3O2
2CH3OH+3O2