题目内容
蛇纹石可用于生产氢氧化镁,简要工程如下:Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol?L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤Ⅱ中,可用于调节溶液pH至7~8的最佳试剂是______(填字母序号)
A.MgO B.Na2CO3 C.蒸馏水
(2)检验粗硫酸镁溶液中Fe2+的方法是:______ (注明试剂、现象).
(3)步骤Ⅲ中制备氢氧化镁反应的离子方程式为______.
(4)步骤Ⅱ沉淀后溶液中主要存在(NH4)2SO4,已知室温下0.1mol?L-1的(NH4)2SO4溶液pH是5,则溶液中离子浓度由大到小的排列为______,溶液中:2c(SO42-)-c(NH4+)=______mol?L-1(用精确数值表示)
(5)某生产科研小组经查阅资料得到以下溶度积Ksp数据(298K时):
Mg(OH)2(S)?Mg2+(aq)+2OH-(aq) Ksp=[Mg2+]?[OH-]2=5.6×10-12
Ca(OH)2(S)?Ca2+(aq)+2OH-(aq) Ksp=[Ca2+]?[OH-]2=4.7×10-6
该科研小组认为可以用熟石灰替代氨水制得氢氧化镁,他们的理由是______.
若沉淀转化反应为:Mg2+(aq)+Ca(OH)2(S)?Mg(OH)2(S)+Ca2+(aq),求此温度下该反应的化学平衡常数K=______ (写出算式和结果).
(2)Fe2+能使酸性高锰酸钾褪色;
(3)步骤III中制备氢氧化镁反应的离子方程式是氨水沉淀镁离子,注意一水合氨是弱电解质;
(4)依据溶液中铵根离子水解,溶液呈酸性,水解程度微弱,分析比较;
(5)依据沉淀转化是想更难溶的方向进行分析判断,Mg(OH)2的溶解度小于Ca(OH)2.
解答:解:(1)步骤II中,可用于调节溶液pH至7~8的目的是和酸反应提高溶液pH,使Fe3+、Al3+等杂质离子沉淀分离除去,
A、加入氧化镁和酸反应能提高溶液pH,生成镁离子,不加入杂质离子,可选;
B、加入碳酸钠能调节溶液pH但假如了钠离子,引入杂质,故不选;
C、蒸馏水对提高溶液pH不好,故不选;
故答案为:A;
(2)Fe2+有还原性,能使酸性高锰酸钾褪色,故答案为:取少量粗硫酸镁溶液,滴加少量酸性KMnO4溶液;若紫红色褪去,说明Fe2+存在;
(3)氨水沉淀镁离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2NH3?H2O═Mg(OH)2↓+2NH4+,故答案为:Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+;
(4)铵根离子水解,溶液呈酸性,c(H+)>c(OH-),.1mol?L-1的(NH4)2SO4溶液中,铵根离子水解微弱,所以得到溶液中的离子浓度大小为:c(NH4+)>c(SO42-)>c(H+)>c(OH-);根据C(NH4+)+C(H+)=2C(SO42-)+C(OH-),2c(SO42-)-c(NH4+)=c(H+)-c(OH-)=10-5-10-9,
故答案为:C(NH4+)>C(SO42-)>C(H+)>C(OH-);10-5-10-9;
(5)依据氢氧化钙和氢氧化镁阴阳离子比相同,可以用溶度积常数比较溶解性强弱,氢氧化钙溶解性大于氢氧化镁,溶液中加入石灰乳可以实现沉淀转化,生成氢氧化镁分离出来;Mg(OH)2的溶解度小于Ca(OH)2,沉淀向更难溶的方向转化,K=
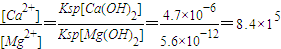 ,
,故答案为:Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化,如:Mg(OH)2和 Ca(OH)2离子个数比相同,Ksp[Mg(OH)2]<Ksp[Ca(OH)2],故沉淀向着溶度积更小的方向转化;8.4×105.
点评:本题考查了难溶物沉淀溶解平衡的分析判断,离子沉淀的条件选择,化学平衡的影响因素,离子方程式的书写,沉淀转化的原理应用,题目综合性较强.

(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
|
| Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN) 6])溶液不变色所需H2O2溶液的量来确
定粗硫酸镁中Fe2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2
溶液的体积如下表所示。
|
| 平行测定数据 | 平均值 | |||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
Fe2+与H2O2溶液反应的离子方程式为 。
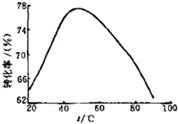
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率
的关系如右图所示。
① 根据图中所示 50℃前温度与Mg2+转化率之间的关系,可判 断此反应是 (填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg2+转化率下降的可能原因 是 。
③Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s) Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Ca(OH)2(s) Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-)= 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
|
|
Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
|
开始沉淀时 |
1.5 |
3.3 |
6.5 |
9.4 |
|
沉淀完全时 |
3.7 |
5.2 |
9.7 |
12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN) 6])溶液不变色所需H2O2溶液的量来确
定粗硫酸镁中Fe2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2
溶液的体积如下表所示。
|
|
平行测定数据 |
平均值 |
|||
|
实验编号 |
1 |
2 |
3 |
4 |
|
|
消耗H2O2溶液的体积/mL |
0.32 |
0.30 |
0.30 |
0.32 |
0.31 |
Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率
的关系如右图所示。
① 根据图中所示 50℃前温度与Mg2+转化率之间的关系,可判 断此反应是 (填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg2+转化率下降的可能原因 是 。
③Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)  Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(
OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(
OH-) = 5.6×10-12
Ca(OH)2(s) Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-)
= 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-)
= 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下: