题目内容
(1)已知:H-H键能为436kJ/mol,N≡N键能为945kJ/mol,N-H键能为391kJ/mol.根据键能计算工业合成氨的反应是
(2)现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
则CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式为
放热
放热
反应(填“吸热”或“放热”),消耗1mol N2合成氨反应的△H=-93kJ/mol
-93kJ/mol
.(2)现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
则CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式为
CO(g)+FeO(s)=Fe(s)+)+CO2(g)△H=-218kJ/mol
CO(g)+FeO(s)=Fe(s)+)+CO2(g)△H=-218kJ/mol
.分析:(1)由N2+3H2?2NH3可知,△H=断裂化学键吸收的能量之和-形成化学键释放的能量之和;
(2)由①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol,
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol,
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol,
根据盖斯定律可知,
得到CO(g)+FeO(s)=Fe(s)+)+CO2(g),以此来解答.
(2)由①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol,
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol,
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol,
根据盖斯定律可知,
| ①×3-②-③×2 |
| 6 |
解答:解:(1)由N2+3H2?2NH3可知,△H=945kJ/mol+3×436kJ/mol-391kJ/mol×6=-93kJ/mol<0,该反应为放热反应,即消耗1molN2合成氨反应的△H=-93kJ/mol,
故答案为:放热;-93kJ/mol;
(2)由①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol,
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol,
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol,
根据盖斯定律可知,
得到CO(g)+FeO(s)=Fe(s)+)+CO2(g)△H=-218kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+)+CO2(g)△H=-218kJ/mol.
故答案为:放热;-93kJ/mol;
(2)由①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol,
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ/mol,
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol,
根据盖斯定律可知,
| ①×3-②-③×2 |
| 6 |
故答案为:CO(g)+FeO(s)=Fe(s)+)+CO2(g)△H=-218kJ/mol.
点评:本题考查反应热的计算,明确化学键与反应热的关系、盖斯定律计算反应热的方法即可解答,(2)中注意目标反应与已知反应的关系为解答的易错点,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
(15分)氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol, N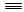 N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是
反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式
;由键能计算说明此反应是
反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H =
。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下, 反应达到平衡的时间为: ,其化学平衡常数K= ;达到平衡后氨气的转化率为: 。
 键能为945kJ· mol—1,N—H键能为391kJ·mol—1。写出合成氨反应的热化学方程式:
键能为945kJ· mol—1,N—H键能为391kJ·mol—1。写出合成氨反应的热化学方程式: