题目内容
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g) Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
SiCl4(g)+2H2(g)
 Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0)某温度、压强下,将一定量的反应物通入密闭容器进行该反应,下列叙述正确的是
| A.反应过程中,若增大压强因为反应速率增大,所以能提高SiCl4的转化率 |
B.已知,一定温度下,反应的平衡常数(k)为定值,若向已经达到平衡状态的容器中再次加入四种物质,若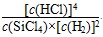 >k,平衡就要向正反应方向移动 >k,平衡就要向正反应方向移动 |
| C.反应至4 min时,若HCl的浓度为0.12 mol·L-1,则H2的反应速率为0.03 mol/(L·min) |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl可被100 mL 1 mol·L-1的NaOH溶液恰好完全吸收 |
D
试题分析:正反应是体积减小的可逆反应,所以增大压强平衡平衡向逆反应方向移动,反应物的转化率降低,A不正确;B不正确,应该是向逆反应方向移动;C不正确,氢气的浓度变化量是0.12mol/L÷2=0.06mol/L,所以氢气的反应速率是0.06mol/L÷4min=0.015 mol/(L·min);反应吸收热量为0.025Q kJ时,生成的HCl是0.1mol,恰好和0.1mol氢氧化钠反应,D正确,答案选D。
点评:在判断外界条件对反应速率的影响时,应该利用勒夏特列原理进行分析和判断。

练习册系列答案
相关题目
 2NH3(g) △H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是
2NH3(g) △H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表。下列叙述正确的是 2SO3(g)(正反应为放热反应),能使SO3的产量增加的措施是( )
2SO3(g)(正反应为放热反应),能使SO3的产量增加的措施是( ) 。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
。恒容时,温度升高,H2浓度增大。下列说法正确的是( )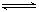 CO+2H2
CO+2H2 nC(g),符合右图所示的结论是( )
nC(g),符合右图所示的结论是( )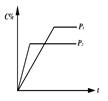
 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。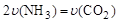 B.密闭容器中总压强不变
B.密闭容器中总压强不变
 N2O4 ΔH<0,在测定NO2的相对分子质量时,下列条件中较为适宜的是
N2O4 ΔH<0,在测定NO2的相对分子质量时,下列条件中较为适宜的是 qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
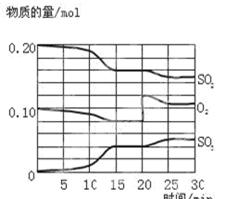
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( ) 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示: