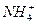题目内容
使10.7g氯化铵和10g氢氧化钙完全反应,生成的氨气全部被200g30%硫酸吸收,所得溶液中硫酸氢铵的质量分数是多少?
11.3%
此题据计算可知完全反应并不是氯化铵和氢氧化钙都用完,其中一种物质是过量的。
2NH4Cl + Ca(OH)2=2NH3+2H2O+CaCl2
10.7/53.5 10/74
="0.2(mol) " =0.135(mol)
Ca(OH)2过量,应以NH4Cl作标准进行计算,设生成NH3为xmol,则x=0.2mol
NH3 + H2SO4=NH4HSO4
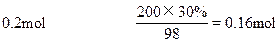
2NH3 + H2SO4=(NH4)2SO4
0.2mol 0.16mol
比较可知硫酸溶液过量,NH3全部转化为NH4HSO4,以NH3作为
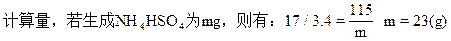
w(NH4HSO4)
=23/(200+0.2×17)×100%=11.3%
2NH4Cl + Ca(OH)2=2NH3+2H2O+CaCl2
10.7/53.5 10/74
="0.2(mol) " =0.135(mol)
Ca(OH)2过量,应以NH4Cl作标准进行计算,设生成NH3为xmol,则x=0.2mol
NH3 + H2SO4=NH4HSO4
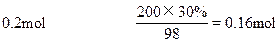
2NH3 + H2SO4=(NH4)2SO4
0.2mol 0.16mol
比较可知硫酸溶液过量,NH3全部转化为NH4HSO4,以NH3作为
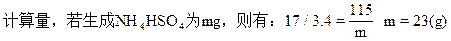
w(NH4HSO4)
=23/(200+0.2×17)×100%=11.3%

练习册系列答案
相关题目