题目内容
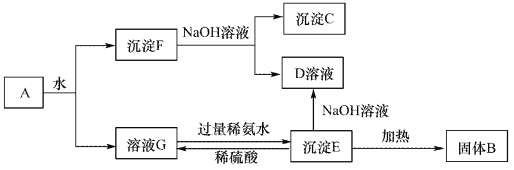
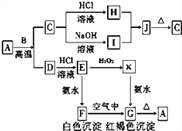
【题目】A是一种红棕色金属氧化物,B、D是常见金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
按要求写方程式:
(1)A与B在高温条件下生成C和D的化学方程式:_______
(2)F在空气中转化为G的化学方程式: _________________________。
(3)C转化为I的离子方程式: _________。
(4)E转化为K的离子方程式: _________。
【答案】 Fe2O3+2A1![]() A12O3+2Fe 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Al2O3+2OH-=2A1O2-+H2O 2Fe2++H2O2+2H+=2Fe3++2H2O
A12O3+2Fe 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Al2O3+2OH-=2A1O2-+H2O 2Fe2++H2O2+2H+=2Fe3++2H2O
【解析】A是一种红棕色金属氧化物,A是氧化铁。B、D是常见金属单质,B与A在高温下反应生成C和D,所以该反应是铝热反应,则B是Al,C是氧化铝,D是Fe。氧化铝与盐酸反应生成H是氯化铝,与氢氧化钠溶液反应生成I是偏铝酸钠,二者反应生成J是一种难溶于水的白色化合物,受热后容易发生分解,J是氢氧化铝,分解生成氧化铝。铁与盐酸反应生成E是氯化亚铁,氯化亚铁与双氧水反应生成K是氯化铁,氯化铁与氨水反应生成G是氢氧化铁,氯化亚铁与氨水反应生成F是氢氧化亚铁,氢氧化亚铁氧化生成氢氧化铁,氢氧化铁分解生成氧化铁。则根据以上分析可知
(1)A与B在高温条件下生成C和D的化学方程式为Fe2O3+2A1![]() A12O3+2Fe;(2)F在空气中转化为G的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。(3)C转化为I的离子方程式为Al2O3+2OH-=2A1O2-+H2O。(4)E转化为K的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
A12O3+2Fe;(2)F在空气中转化为G的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。(3)C转化为I的离子方程式为Al2O3+2OH-=2A1O2-+H2O。(4)E转化为K的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。

 名校课堂系列答案
名校课堂系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃