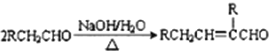题目内容
【题目】自然界的矿物,岩石的成因和变化收到许多条件的影响。地壳内每增加1km,压强增大约25000-30000kPa。在地壳内SiO2和HF存在一下平衡:SiO2(s) +4HF(g) ![]() SiF4(g)+ 2H2O(g) +148.9kJ。
SiF4(g)+ 2H2O(g) +148.9kJ。
(1)写出H2O的电子式:___________,SiF4的结构式:____________
(2)在地壳深处容易有___________气体逸出,在地壳浅处容易有___________沉积。该反应的平衡常数表达式为:K=_______________。如果上述反应的平衡常数K值变大,该反应_______(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为______。
【答案】  、
、  SiF4、H2O SiO2
SiF4、H2O SiO2 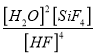 a、d b、c 0.0010mol/(L min)
a、d b、c 0.0010mol/(L min)
【解析】(1)本题考查化学用语,H2O为共价化合物,其电子式为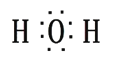 ,Si与四个F形成共价键,即结构式为
,Si与四个F形成共价键,即结构式为 ;(2)本题考查勒夏特列原理、化学平衡常数,根据信息,地壳内每增加1km,压强增大约25000-30000kPa,地壳中压强增大,根据勒夏特列原理,增大压强,此反应的平衡向正反应方向移动,即地壳中容易有气体SiF4和H2O逸出,地壳浅处,压强减小,平衡向逆反应方向移动,因此地壳浅处容易有SiO2沉积,根据平衡常数的定义,则该反应的平衡常数K=
;(2)本题考查勒夏特列原理、化学平衡常数,根据信息,地壳内每增加1km,压强增大约25000-30000kPa,地壳中压强增大,根据勒夏特列原理,增大压强,此反应的平衡向正反应方向移动,即地壳中容易有气体SiF4和H2O逸出,地壳浅处,压强减小,平衡向逆反应方向移动,因此地壳浅处容易有SiO2沉积,根据平衡常数的定义,则该反应的平衡常数K= 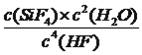 ,a、根据化学平衡常数的定义,K值变大,说明平衡向正反应方向移动,故a正确;b、化学平衡常数只受温度影响,此反应是放热反应,K值变大,说明改变的因素是降低温度,降低温度,化学反应速率降低,降低温度,化学平衡向正反应方向移动,逆反应速率又增大,故b错误;c、根据a选项分析,故c错误;d、根据b选项分析,故d正确;(3)考查化学平衡状态的判断,a、用不同物质的化学反应速率表示反应达到平衡,要求反应反应一正一逆,且反应速率之比等于化学计量数之比,即v正(HF)=2v逆(H2O),故a错误;b、根据a选项分析,v正(H2O)=2v逆(SiF4),故b正确;c、根据化学平衡状态的定义,SiO2的质量保持不变,说明反应达到平衡,故c正确;d、化学平衡是动态平衡,故d错误;(4)考查化学反应速率的计算,,根据反应方程式,1molSiO2完全反应,气体质量增加的是SiO2的量,即60g,容器内气体的密度增大0.12g·L-1,气体质量增加0.12×2g=0.24g,消耗HF的物质的量为0.24×4/60mol=0.016mol,根据化学反应速率的数学表达式v(HF)=0.016/(2×8)mol/(L·min)=0.0010 mol/(L·min)。
,a、根据化学平衡常数的定义,K值变大,说明平衡向正反应方向移动,故a正确;b、化学平衡常数只受温度影响,此反应是放热反应,K值变大,说明改变的因素是降低温度,降低温度,化学反应速率降低,降低温度,化学平衡向正反应方向移动,逆反应速率又增大,故b错误;c、根据a选项分析,故c错误;d、根据b选项分析,故d正确;(3)考查化学平衡状态的判断,a、用不同物质的化学反应速率表示反应达到平衡,要求反应反应一正一逆,且反应速率之比等于化学计量数之比,即v正(HF)=2v逆(H2O),故a错误;b、根据a选项分析,v正(H2O)=2v逆(SiF4),故b正确;c、根据化学平衡状态的定义,SiO2的质量保持不变,说明反应达到平衡,故c正确;d、化学平衡是动态平衡,故d错误;(4)考查化学反应速率的计算,,根据反应方程式,1molSiO2完全反应,气体质量增加的是SiO2的量,即60g,容器内气体的密度增大0.12g·L-1,气体质量增加0.12×2g=0.24g,消耗HF的物质的量为0.24×4/60mol=0.016mol,根据化学反应速率的数学表达式v(HF)=0.016/(2×8)mol/(L·min)=0.0010 mol/(L·min)。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案