题目内容
(6分)由铜片、锌片和200mL稀硫酸组成的原电池中,当铜片上放出3.36L(标状况)气体时(锌片上无气体产生),硫酸恰好反应完.计算:
(1)产生这些气体消耗的金属是哪一种,消耗的质量是多少;
(2)有多少电子通过了导线;
(3)硫酸溶液的物质的量浓度是多少.
(已知相对原子质量:Zn 65 Cu 64 S 32 O 16 H 1 )
【答案】
(1)锌,9.75g.(2)0.3mol.(3)0.75mol/L
【解析】在原电池中较活泼的金属失去电子,作负极,发生氧化反应,所以锌是负极,失去的电子通过导线传递中正极铜电极上,溶液中的氢离子达到电子,被还原生成氢气。电极反应式分别为Zn-2e-=Zn2+、2H++2e-=H2↑。氢气是3.36L,其物质的量是
 ,所以得到的电子是0.15mol×2=0.3mol。根据得失电子守恒可知被溶解的锌是0.15mol,质量是0.15mol×65g/mol=9.75g。根据原子守恒可知楼硫酸的物质的量是0.15mol,所以浓度是
,所以得到的电子是0.15mol×2=0.3mol。根据得失电子守恒可知被溶解的锌是0.15mol,质量是0.15mol×65g/mol=9.75g。根据原子守恒可知楼硫酸的物质的量是0.15mol,所以浓度是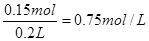 。
。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目