题目内容
准确称取
6 g铝土矿(含Al2O3、Fe2O3、SiO2)样品放入盛有100 mL H2SO4的烧杯中充分反应后过滤,再向溶液中加入10 mol/L NaOH溶液,产生沉淀的质量m(g)与所加NaOH溶液的体积V(mol)关系如图所示.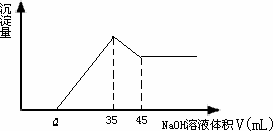
则①H2SO4溶液的物质的量浓度为:________.
②若a=2.75则铝土矿中各成分的质量百分含量是多少?
③a的取值范围是多少?a值越大,________含量越少.
答案:
解析:
解析:
|
①1.75 mol/L. ②解:Ⅰ、计算Al2O3的量:由Al(OH)3+OH-=AlO2-+2H2O(a)得 n(Al2O3)= ω(Al2O3)= Ⅱ、计算Fe2O3的量:由M3++3OH-=M(OH)3和(a)知,Fe3+所消耗的NaOH为:(35-30-2.75)mL,所以, n(Fe2O3)= ω(Fe2O3)= ∴ω(SiO2)=5% ③a的取值范围是多少?a值越大,Fe2O3含量越少. 解:由于铝土矿中Al2O3的含量不变,所以Fe2O3的含量越高消耗的NaOH越多,当其量最大即趋近于15%时,a值最小则有:n(Fe3+)= 其消耗V(NaOH)= 那么当杂质全为SiO2时,a值最大且为amax=5,所以1.625<a<5. |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




