题目内容
【题目】反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H1=a kJ/mol;
FeO(s)+CO(g) △H1=a kJ/mol;
②CO(g)+1/2O2(g) ![]() CO2(g) △H2=b kJ/mol
CO2(g) △H2=b kJ/mol
测得在不同温度下,反应①的平衡常数 K 值随温度的变化如下:
![]()
(1)若 500℃时进行反应①,CO2起始浓度为 2 mol·L-1,CO2的平衡浓度为____________。
(2)反应①中的 a_____________0(填“大于”“小于”或“等于”)。
(3)700℃反应已经①达到平衡,要使该平衡正向移动,其他条件不变时,可以采取的措施有_____________(填序号)
A.缩小反应器体积 B.通入 CO2
C.升高温度到 900℃ D.使用合适的催化剂
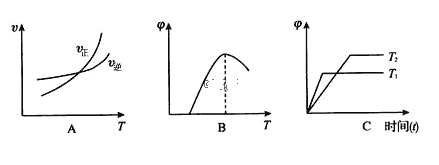
(4)下列图像符合反应①的是_____(填序号)(图中 v是速率、Φ为混合物中 CO2含量, T 为温度且 T1> T2)
(5) 2Fe(s)+O2(g) ![]() 2FeO(s) △H3,该反应的△H3= ________kJ/mol。(用含 a、b的代数式表示)
2FeO(s) △H3,该反应的△H3= ________kJ/mol。(用含 a、b的代数式表示)
【答案】1mol/L > BC A 2(a+b)
【解析】
(1)若 500℃时进行反应①,CO2起始浓度为 2 mol·L-1,设CO2的平衡浓度为cmol/L,则变化浓度为(2-c)cmol/L,由Fe(s)+CO2(g) ![]() FeO(s)+CO(g)可知CO的变化浓度和平衡浓度均为(2-c)cmol/L,结合平衡常数K=
FeO(s)+CO(g)可知CO的变化浓度和平衡浓度均为(2-c)cmol/L,结合平衡常数K=![]() 计算;
计算;
(2) 由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断a值的符号;
(3) 根据化学平衡移动的影响因素知识来回答;
(4) 根据化学平衡移动和化学反应速率的影响因素知识来回答;
(5) 已知:①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H1=a kJ/mol,②CO(g)+1/2O2(g)
FeO(s)+CO(g) △H1=a kJ/mol,②CO(g)+1/2O2(g) ![]() CO2(g) △H2=b kJ/mol,由盖斯定律可知(①+②)
CO2(g) △H2=b kJ/mol,由盖斯定律可知(①+②)![]() 可得2Fe(s)+O2(g)
可得2Fe(s)+O2(g) ![]() 2FeO(s) ,据此计算△H3。
2FeO(s) ,据此计算△H3。
(1) 若 500℃时进行反应①,CO2起始浓度为 2 mol·L-1,设CO2的平衡浓度为cmol/L,则变化浓度为(2-c)cmol/L,由Fe(s)+CO2(g) ![]() FeO(s)+CO(g)可知CO的变化浓度和平衡浓度均为(2-c)cmol/L,则K=
FeO(s)+CO(g)可知CO的变化浓度和平衡浓度均为(2-c)cmol/L,则K=![]() =
=![]() =1,解得:c=1,即CO2的平衡浓度为1mol/L;
=1,解得:c=1,即CO2的平衡浓度为1mol/L;
(2) 由表中数据可知,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0;
(3) A.缩小反应器容积,压强增大,化学平衡不移动,故A错误;
B.通入适量CO2,增大CO2的浓度,化学平衡向右移动,故B正确;
C.升高温度到900℃,化学平衡正向移动,故C正确;
D.使用合适的催化剂,不会引起化学平衡的移动,故D错误;
故答案为BC;
(4) A.升高温度平衡向吸热方向移动,即向正方向移动,故A正确;
B.升高温度平衡向吸热方向移动,即向正方向移动,混合物中CO的含量升高,故B错误;
C.由图知,T1曲线速率快,则T1>T2,据平衡移动,对应的CO的含量也升高,故C错误;
故答案为:A;
(5) 已知:①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H1=a kJ/mol,②CO(g)+1/2O2(g)
FeO(s)+CO(g) △H1=a kJ/mol,②CO(g)+1/2O2(g) ![]() CO2(g) △H2=b kJ/mol,由盖斯定律可知(①+②)×2可得2Fe(s)+O2(g)
CO2(g) △H2=b kJ/mol,由盖斯定律可知(①+②)×2可得2Fe(s)+O2(g) ![]() 2FeO(s) ,则△H3=2(a+b)kJ/mol。
2FeO(s) ,则△H3=2(a+b)kJ/mol。

【题目】目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中![]() 的含量及有效地开发利用
的含量及有效地开发利用![]() ,引起全世界的关注:
,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒![]() 杂质
杂质![]() ,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为
,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为![]() ,请写出对应的化学方程式并配平: ______ ;
,请写出对应的化学方程式并配平: ______ ;
(2)将不同量的![]() 和
和![]() 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应![]()
![]() ,得到如下两组数据:
,得到如下两组数据:
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所 需时间 | ||
| CO |
| CO | |||
1 | 650 | 2 | 4 |
|
| 5 |
2 | 900 | 1 | 2 |
|
| 3 |
①实验2条件下平衡时![]() 体积分数为 ______ ;
体积分数为 ______ ;
②下列方法中可以证明上述已达平衡状态的是 ______ ;
![]() 单位时间内生成nmol
单位时间内生成nmol![]() 的同时生成nmolCO
的同时生成nmolCO
![]() 容器内压强不再变化
容器内压强不再变化![]() 混合气体密度不再变化
混合气体密度不再变化
![]() 混合气体的平均相对分子质量不再变化
混合气体的平均相对分子质量不再变化![]() 的质量分数不再变化
的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值![]() 如下表,则反应
如下表,则反应![]() ,在900K时,该反应平衡常数的对数值
,在900K时,该反应平衡常数的对数值![]() ______ .
______ .
气化反应式 | lgK | ||
700K | 900K | 1200K | |
|
|
|
|
|
|
|
|
(3)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
![]()
![]()
![]()
![]()
![]()
![]()
请写出CO除![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
(4)![]() 时,
时,![]() 和
和![]() 的溶度积常数分别是
的溶度积常数分别是![]() 和
和![]() ,某含有
,某含有![]() 沉淀的悬浊液中
沉淀的悬浊液中![]() ,如果加入等体积的
,如果加入等体积的![]() 溶液,若要产生
溶液,若要产生![]() 沉淀,加入
沉淀,加入![]() 溶液的物质的量浓度最小是 ______
溶液的物质的量浓度最小是 ______ ![]() .
.
(5)![]() 时,在
时,在![]() 醋酸中加入V
醋酸中加入V![]() 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .
溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .
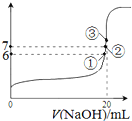
A.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液中,由水电离出的
溶液中,由水电离出的![]() 相等
相等
B.①点时![]() ,此时溶液中,
,此时溶液中,![]()
C.②点时,溶液中的![]()
D.③点时![]() ,此时溶液中
,此时溶液中![]()
(6)如图是一种新型燃料电池,它以CO为燃料,一定比例的![]() 和
和![]() 熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:
熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:
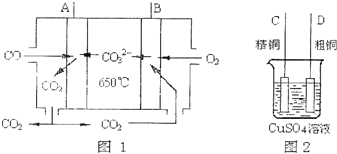
①写出A极发生的电极反应式 ______ ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与 ______ 极![]() 填“C”或“D”
填“C”或“D”![]() 相连.
相连.