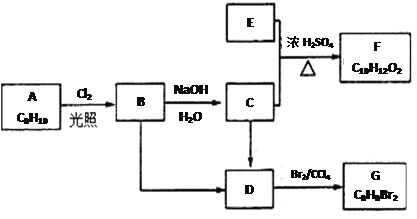
题目内容
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是

A. 曲线 M 表示 pH与![]() 的变化关系
的变化关系
B. Ka2(H2Y)=10-2.7
C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+)
D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
【答案】B
【解析】A. Ka1(H2Y)=![]() ,随着pH 增大,c(H+)减小,
,随着pH 增大,c(H+)减小,![]() 增大,
增大,![]() 增大,故曲线 M 表示 pH与
增大,故曲线 M 表示 pH与![]() 的变化关系,选项A正确;B、曲线 N 表示 pH与
的变化关系,选项A正确;B、曲线 N 表示 pH与![]() 的变化关系,当pH=3时,c(H+)=10-3,
的变化关系,当pH=3时,c(H+)=10-3,![]() =1.3,
=1.3, ![]() =101.3,Ka2(H2Y)=
=101.3,Ka2(H2Y)=![]() =10-3×10-1.3= 10-4.3 ,选项B错误;C. d 点溶液中存在电荷守恒: c(H+)+c(K+)=2c(Y2-)+ c(HY-)+c(OH -),故c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+),选项C正确;D、交点 e 的溶液中:
=10-3×10-1.3= 10-4.3 ,选项B错误;C. d 点溶液中存在电荷守恒: c(H+)+c(K+)=2c(Y2-)+ c(HY-)+c(OH -),故c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+),选项C正确;D、交点 e 的溶液中:![]() =1.5,
=1.5,![]() ,则c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -),选项D正确。答案选B。
,则c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -),选项D正确。答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目