题目内容
为了预防碘缺乏病,国家规定每千克食盐中应含有40~50毫克的碘酸钾.为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾.将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠(Na2S2O3)溶液滴定,用去18.00mL时蓝色刚好褪去.试通过计算说明该加碘食盐是否为合格产品.有关反应如下(提示:用关系式法做,Na2S2O3、Na2S4O6均为无色溶液):
(1)KIO3+5KI+3H2SO4→3I2+3H2O+3K2SO4
(2)I2+2Na2S2O3→2NaI+Na2S4O6.
(1)KIO3+5KI+3H2SO4→3I2+3H2O+3K2SO4
(2)I2+2Na2S2O3→2NaI+Na2S4O6.
n (Na2S2O3)=0.030 mol/L×0.018 L=0.00054 mol,
根据两步反应的化学方程式,可以找出关系式:KIO3----3I2----6Na2S2O3,即KIO3-6Na2S2O3,
设碘酸钾的质量是m
KIO3-------------------6Na2S2O3
214g 6 mol
m 0.00054 mol
214g:6mol=m (KIO3):0.00054 mol
m(KIO3)=
=0.01926 g=19.26 mg,
则每千克食盐中所含KIO3的质量为:
=45 mg,在40 mg~50 mg范围内,所以该加碘食盐是合格产品,
答:在40 mg~50 mg范围内,所以该加碘食盐是合格产品.
根据两步反应的化学方程式,可以找出关系式:KIO3----3I2----6Na2S2O3,即KIO3-6Na2S2O3,
设碘酸钾的质量是m
KIO3-------------------6Na2S2O3
214g 6 mol
m 0.00054 mol
214g:6mol=m (KIO3):0.00054 mol
m(KIO3)=
| 0.00054mol×214g |
| 6mol |
则每千克食盐中所含KIO3的质量为:
| 19.26mg |
| 0.428 |
答:在40 mg~50 mg范围内,所以该加碘食盐是合格产品.

练习册系列答案
相关题目
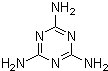
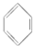 ⑥
⑥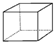 ⑦
⑦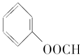 ⑧CH3OH ⑨HCOOH
⑧CH3OH ⑨HCOOH