题目内容
【题目】
钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是______。
②原子半径r(Cl)_____r(Mg),离子半径r(O2-)______r(Mg2+)(填“>”、“<”或“=”)。
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于_____晶体,Ni与CO之间的化学键称为__________,提供孤对电子的成键原子是_________。(填元素符号)
(5)一种钛镍合金的立方晶胞结构如图所示:
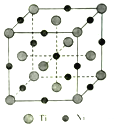
①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
【答案】 1s22s22p63s23d24s2或[Ar] 3d24s2 第4周期第VIII族 正四面体 sp3 MgCl2是离子晶体,TiCl4是分子晶体,离子晶体键能比分子间作用力大得很多 < > 分子 配位键 ![]() 6
6 ![]()
【解析】(1)基态Ti原子的电子排布式为1s22s22p63s23d24s2或[Ar] 3d24s2,Ni在元素周期表中的位置是第4周期第VIII族。
(2) SO42-的中心原子S的价层电子对数n=![]() ,所以中心原子的轨道杂化类型是sp3,S原子与4个O原子形成4个σ键,所以SO42-立体构型为正四面体。
,所以中心原子的轨道杂化类型是sp3,S原子与4个O原子形成4个σ键,所以SO42-立体构型为正四面体。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔、沸点比TiCl4高得多,其原因是MgCl2是离子晶体,TiCl4是分子晶体,离子晶体键能比分子间作用力大得很多。
②氯和镁都是第3周期的主族元素,氯的原子序数是较大。同周期元素原子序数越大,原子半径越小,所以原子半径r(Cl)< r(Mg);电子层结构相同的简单离子,核电荷数越大半径越小。氧离子和镁离子电子层结构相同,所以离子半径r(O2-)>r(Mg2+)。
(4) Ni(CO)4常温下为无色液体,该化合物的熔点较低,所以Ni(CO)4的固体属于分子晶体。配合物Ni(CO)4的中心原子Ni与配体CO之间的化学键称为配位键,提供孤对电子的成键原子是![]() 。
。
(5)此钛镍合金的立方晶胞结构与氯化钠晶胞相似,氯化钠晶胞中两种离子的配位数都是6。
①该合金中Ti的配位数为6。
②该晶胞中含Ti原子数为![]() 、Ni原子数为
、Ni原子数为![]() ,所以1mol该晶胞中有4mol TiNi,质量为4
,所以1mol该晶胞中有4mol TiNi,质量为4![]() ,若晶胞的边长为a,则1mol该晶胞体积为a3NA,由合金的密度为d g/cm3=
,若晶胞的边长为a,则1mol该晶胞体积为a3NA,由合金的密度为d g/cm3=![]() ,所以晶胞边长a=
,所以晶胞边长a=![]() cm=
cm= ![]() pm。
pm。